水素原子一個で強力な触媒をケージング ―アルツハイマー病関連のアミロイドを低分子で副作用を抑えて分解する―
東京大学大学院薬学系研究科 有機合成化学教室 金井求 教授、京都大学化学研究所 梶弘典 教授、東京大学大学院薬学系研究科 機能病態学教室 富田泰輔 教授、和歌山県立医科大学薬学部 相馬洋平 教授の研究グループは共同で、分子に水素原子を一個つけるだけで毒性を低減させて脳内への移行性を向上し、副作用を抑えてアルツハイマー病モデルマウスの脳内で毒性のあるアミロイドβ(Aβ)凝集体(アミロイド)を分解する触媒の開発に成功しました。
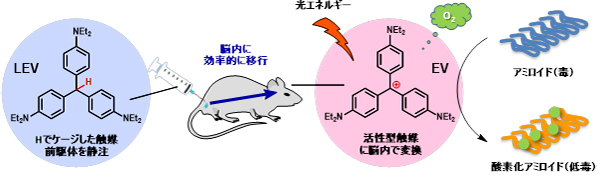
本研究では、アミロイドを分解する触媒の活性を従来に比べて200倍向上させたEV(下図、ピンク背景の化合物)を開発し、体内深部に到達する微弱な光でもアミロイドを分解できる可能性を拡げました。しかしEVは毒性が高かったために分子の構造に工夫をほどこして、LEV(下図、青背景の化合物)を見い出しました。LEVはEVに水素原子を一個つけただけの分子ですが、毒性が格段に低く、また脳に効率的に移行しました。LEVは脳内でEVに変換され、副作用を引き起こすことなく、アルツハイマー病モデルマウスの脳内で強力にAβアミロイドを分解しました。
本成果は、世界中の人々に医薬の恩恵を平等に与えうる安価な低分子を用いて、アルツハイマー病を克服する薬の開発の第一歩となると考えられます。
社会の高齢化に伴い、アルツハイマー病型認知症の患者数は世界的に増加の一途を辿っており、その治療法の開発は極めて重要な創薬の懸案課題です。アルツハイマー病の発症は、Aβとよばれるペプチドが加齢とともにアミロイドとよばれる異常な凝集体を形成することと関連していると考えられています。実際、最近承認されたレカネマブという薬は、Aβアミロイドに結合してそれを脳内から除去することで抗アルツハイマー病作用を示します。病因の関連物質であるアミロイドを減少させる世界初の薬が見い出されたことは大きな進歩ですが、レカネマブは分子量が約15万のタンパク質(抗体)で、生産と品質管理に手間がかかり、高価であるという難点があります。
我々の研究グループは、特定の化学反応を促進する触媒の機能を低分子に導入することで、従来の低分子薬の適応を拡張できると考えて研究を行っています。「触媒医療」と名付けたこの概念に基づき、生産と品質管理が容易で安価な低分子で抗体と同等の作用を発揮する分子を取得することを目標に研究を行った結果、極少量でアミロイドの分解・低毒化を促せる超高活性な分子EVを見い出しました。EVは分子量が456しかありませんが、抗体と同様にアミロイドを解毒することができます。また、アミロイド以外のタンパク質やペプチドが存在しても、EVはアミロイドを選択的に分解する特長を有しています。この特長は、EVがアミロイドに結合すると光エネルギーを空気中の酸素に効率的に受け渡して、これを活性化するためであることが計算科学により明らかとなりました。しかしEVは自身の毒性が高い上に、静注で投与してもアミロイドが蓄積する脳内に移行しにくいため、副作用が強いという欠点がありました。より優れた分子を目指して研究を続けたところ、EVにたった一個の水素原子(H)を付加してプロドラッグとしたLEVを見い出しました。アミロイドが存在している状況でLEVにオレンジ光を照射すると、LEVはEVに自己触媒的に変換され、生じるEVはアミロイド選択的に酸素との反応による分解である酸素化を引き起こし、その毒性を低下させました。アルツハイマー病モデルマウスにLEVを静注すると効果的に脳内に移行し、頭部にオレンジ色のLEDを照射すると、副作用を引き起こすことなく、生きたマウスの脳内でAβアミロイドの分解が進行しました(図1)。さらにLEVが、ヒトアルツハイマー病患者の脳由来のAβアミロイドや、神経細胞死に関わるタウのアミロイドに対しても有効性を示すことも確認できました。

触媒EVあるいはLEVを静注後、頭部にオレンジ光を10分間照射、この処置を5日に渡って5回繰り返すと、未処理群と比較してAβの酸素化が顕著に進むことが分かった。また、EVではマウス頭皮にやけどのような副作用が見られたが、LEVでは副作用が見られなかった。
本研究は、科研費「基盤研究S(課題番号:23H05466)」、「基盤研究A(課題番号:19H01015)」、「基盤研究B(課題番号:21H02622, 21H02602)」、「基盤研究C(課題番号:22K05252, 18K06653)」、「学術変革研究(課題番号:23H04909, 20H05843, 20H05840)」、「若手研究(課題番号:21K15220)」、「特別研究員奨励費(課題番号:20J22142)」、AMED(課題番号:19dm0107106, 19dm0307030, 22gm6410017)」、「JST-さきがけ(課題番号:JPMJPR2279)」の支援により実施されました。
●用語解説●
創薬:基礎研究、非臨床試験、臨床試験(治験)などの過程を経て、新しい薬をゼロから産み出す過程のこと。
ペプチド:アミノ酸がペプチド結合で連なった分子のうち、タンパク質よりは分子量の小さな群の呼称。
触媒:化学反応を促進し、反応の後に再生されて何回も繰り返し機能し、自身よりも多量の目的物を生成できる分子のこと。
低分子:分子量が1000程度以下の、比較的小さな分子。人間が設計・合成・機能改良でき、一般に安価で入手容易であるという特長を有する。
触媒医療:生命は分子と化学反応から創発し、生体内の化学反応は通常、タンパク質(酵素)が促進するが、低分子触媒に生体内の化学反応を促進する機能を持たせることで酵素を代替し、これにより酵素欠損や失活などの疾患原因を補って病気を治していく創薬概念。
プロドラッグ:副作用や毒性等を軽減するために薬物の分子構造を改変し、投与後に体内での代謝などの化学反応により活性のある構造に変換される薬物前駆体のこと。
自己触媒:自分自身を作る触媒のこと。自己触媒反応により、非線形な反応の加速が起こる。
酸素化:標的となる分子(今回はアミロイド)に対して、空気中あるいは生体内の酸素を結合させる化学反応のこと。
 京都大学 化学研究所
京都大学 化学研究所 国際共同利用・共同研究拠点
国際共同利用・共同研究拠点