光エネルギーで新しい化学修飾核酸を合成 ―核酸リン原子の第三級アルキル化に成功―
京都大学化学研究所 大宮寛久 教授、長尾一哲 助教、同大学大学院薬学研究科 太田健治 博士後期課程学生、武田薬品工業株式会社 佐々木悠祐 博士、秦大 博士、分子科学研究所 瀬川泰知 准教授らの共同研究グループは、これまで実現困難であった核酸リン原子の第三級アルキル化反応の開発に成功し、新しい化学修飾核酸を合成しました。
DNAやRNAといった核酸やその誘導体を基本骨格とした核酸医薬品は、従来の低分子医薬品や抗体医薬品とは異なる作用機序で働くため、新たな治療法として注目されています。DNAやRNAは、核酸塩基・糖の環骨格・ホスホジエステル基から構成させるヌクレオチドが鎖状に連なった高分子化合物であるため、その構成成分を化学修飾することは、新しい核酸医薬品の創出に繋がります。特に、天然の核酸内のホスホジエステル基は生体内の酵素により容易に分解されてしまうため、代謝安定性の向上を目的としたホスホジエステル基の化学修飾が精力的に行われています。中でも、ホスホジエステル基の非架橋酸素原子をアルキル基に置換したアルキルホスホン酸ジエステル修飾は、架橋部位の電荷が中性となるため、代謝安定性に加えて負電荷を有するホスホジエステル基にはない物性の付与が期待されます。しかし、従来法ではかさの低いアルキル基はリン原子に導入できる一方で、かさ高い第三級アルキル基の導入は困難でした。
本研究では、光エネルギーを使用した温和な条件で発生させたカルボカチオン種を活用することで、核酸リン原子の第三級アルキル化反応の開発に成功しました。本成果はかさ高い第三級アルキル基が導入された化学修飾核酸の合成を通じて、新たな核酸医薬品の創出に繋がることが期待されます。
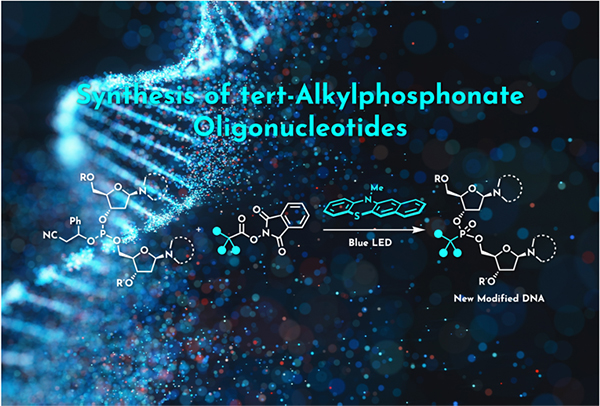
本研究の概要図 : 核酸リン原子の第三級アルキル化反応
核酸医薬品は、従来の低分子医薬品や抗体医薬品では創薬困難とされるRNAといった標的分子を認識できると同時に、標的分子に対する高い特異性を有するため、新たな治療法として注目されています。この核酸医薬品は、一般的に十から数十個のヌクレオチドから成るオリゴヌクレオチドであるため化学合成により製造可能な分子です。したがって、ヌクレオチドを構成する核酸塩基・糖の環骨格・ホスホジエステル基を化学修飾することは、新しい核酸医薬品の創出に繋がります。たとえば、ホスホジエステル基の化学修飾は、核酸分解酵素に対する安定性や薬物動態に影響します(図1上)。ホスホジエステル基の非架橋酸素原子をアルキル基に置換したアルキルホスホン酸ジエステル構造は、架橋部位の電荷が中性となるため、負電荷を有するホスホジエステル基にはない物性、たとえば膜透過性の向上といった性質が期待されます。しかし、核酸リン原子に導入できるアルキル基は、メチル基や第一級あるいは第二級アルキル基のようなかさの低いものに制限されていました(図1下)。そのような従来のアルキルホスホン酸ジエステル構造は塩基性条件に不安定で、オリゴヌクレオチド合成の際や種々の誘導化の過程において分解される恐れがあり、そうした内在的な安定性の低さから核酸医薬品への応用が阻まれてきました。
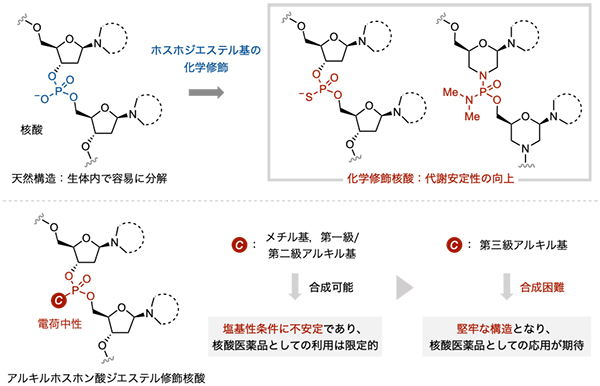
図1 : ホスホジエステル基の化学修飾とアルキルホスホン酸ジエステル修飾核酸
本研究グループは、青色 LED照射下、有機硫黄化合物と第三級脂肪族カルボン酸誘導体を用いることで、二つのデオキシリボヌクレオシド構造と脱離基を持つ亜リン酸エステルのリン原子第三級アルキル化が進行することを見出しました(図2)。有機硫黄化合物と脂肪族カルボン酸誘導体に青色LEDを照射することで、カルボカチオン等価体が発生する独自の手法を活用しました。具体的には、青色 LED照射により、有機硫黄化合物から脂肪族カルボン酸誘導体へ一電子が移動し、一電子を受け取った脂肪族カルボン酸誘導体は分解して炭素ラジカルを与えます。その後、生じた炭素ラジカルが一電子を有機硫黄化合物に渡すことでカルボカチオン種を与えます。
本研究の成功の鍵は、脱離能の高い脱離基を独自に設計したことです。オリゴヌクレオチド合成において汎用される脱離基(シアノエチル基)のままでは、全く目的の化合物は得られませんでした。副生成物を解析することで、核酸のリン原子とカルボカチオン等価体との反応で生じる中間体において、従来のシアノエチル基の代わりにデオキシリボヌクレオシド構造が脱離してしまうことが原因であると推定しました。そこで、脱離能の高い脱離基を設計することで、目的の第三級アルキルホスホン酸ジエステルを得ることに成功しました。
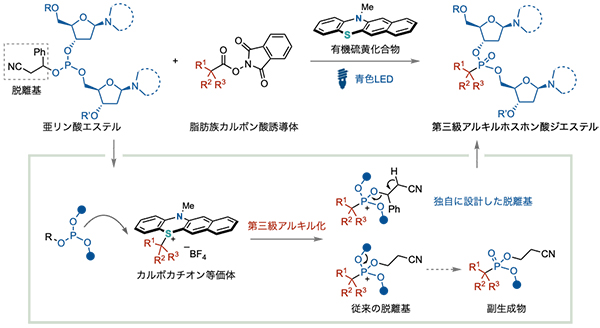
図2 : 本手法の反応機構
本手法は、1)温和な反応条件であるため高い官能基許容性を示す、2)入手容易な脂肪族カルボン酸が原料となることから、多様な第三級アルキルホスホン酸ジエステルを構築することが可能です(図3)。 具体的には、DNAを構成する4種類のピリミジン塩基やプリン塩基を適用でき、「同一デオキシリボヌクレオシド構造」だけでなく、「異なる核酸塩基で構成される非対称なデオキシリボヌクレオシド構造」を有する亜リン酸エステルのリン原子第三級アルキル化も可能でした。本手法により、かさ高い第三級アルキル基が導入された15種類の新しい化学修飾核酸の合成に成功しました。
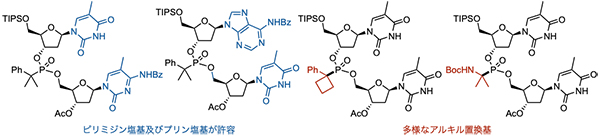
図3 : 本手法で構築した第三級アルキルホスホン酸ジエステル
任意の位置に第三級アルキルホスホン酸ジエステル構造が組み込まれたオリゴヌクレオチド合成にも成功しました(図4)。本手法により得られた第三級アルキルホスホン酸ジエステルを有する核酸誘導体をホスホロアミダイトへと誘導し、固相合成法に用いることで、10個のデオキシリボヌクレオチドからなるオリゴヌクレオチドを合成しました。具体的には、末端や内部に第三級アルキルホスホン酸ジエステル構造を導入した5種類のオリゴヌクレオチド合成に成功しました。誘導化やオリゴヌクレオチド合成の反応条件において、第三級アルキルホスホン酸ジエステル構造の分解は認められず、この構造の堅牢さが示されました。
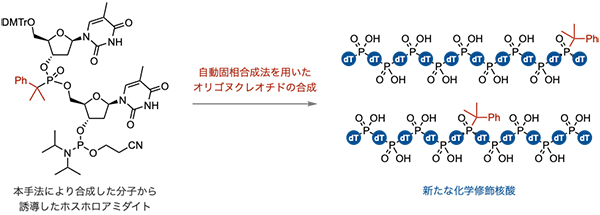
図4 : オリゴヌクレオチドの合成
本研究では、温和な条件下で発生させたカルボカチオンを活用することで、核酸リン原子の第三級アルキル化反応の開発に成功し、かさ高い第三級アルキル基が導入された化学修飾核酸を合成しました。実際にオリゴヌクレオチドへの導入を実証し、その過程において本化学構造の堅牢性を示すことができました。立体障害による堅牢性が生物学的利用能を高め新たな核酸医薬品の創出に繋がることが期待されます。現在、得られたオリゴヌクレオチドの生物学的な物性も含めた更なる評価を進めており、実際の創薬応用へと展開していきます。
本研究は、武田薬品工業株式会社、JSPS科学研究費補助金「基盤研究A(JP21H04681)」、「学術変革領域研究A 炭素資源変換を革新するグリーン触媒科学(JP23H004912)」、「特別研究員奨励費(JP22J20280)」、JST戦略的創造研究推進事業さきがけ「電子やイオン等の能動的制御と反応(JPMJPR19T2)」の支援を受けて実施されました。
●用語解説●
化学修飾核酸:天然には存在しない人工的に化学修飾が施された核酸。
DNA:デオキシリボ核酸の略語。デオキシリボース骨格・リン酸・4種類の核酸塩基(アデニン、チミン、グアニン、シトシン)から構成される。
RNA:リボ核酸の略語。リボース骨格・リン酸・4種類の核酸塩基(アデニン、ウラシル、グアニン、シトシン)から構成される。
ホスホジエステル基:リン酸の二つのヒドロキシ基と二つのアルコールが脱水縮合したエステル。天然のDNAおよびRNA鎖は糖部位が本結合によって繋がれた構造から成る。
アルキル基:アルカンから水素原子を1個除いた炭化水素基の総称。
アルキルホスホン酸ジエステル:ホスホジエステル基上の非架橋酸素原子をアルキル基に置換した構造。
カルボカチオン:炭素原子上に正の電荷を持つ化学種のことを指す。
オリゴヌクレオチド:ヌクレオチド単位が鎖状に連なった高分子化合物。
亜リン酸エステル:三価の亜リン酸のヒドロキシ基とアルコールが脱水縮合したエステル。
官能基許容性:ある反応において、どれ程多様な官能基が利用できるかという度合い。
ホスホロアミダイト:亜リン酸ジエステルのモノアミド体。オリゴ核酸の化学合成において、モノマーの原料として汎用される。
固相合成法:固相上に担持しながら原料や反応剤を処理することによって鎖長を伸長し、高分子化合物を合成する手法。
 京都大学 化学研究所
京都大学 化学研究所 国際共同利用・共同研究拠点
国際共同利用・共同研究拠点