膜を傷つけず細胞内に薬を届ける新技術!―インクジェットプリンター技術の活用でがん細胞に直接アプローチ―
本研究は、2023年10月5日に米国化学会「ACS Applied Materials & Interfaces」にオンライン掲載されました。
大阪公立大学大学院理学研究科 大村美香 博士課程学生、中瀬生彦 教授、京都大学化学研究所 二木史朗 教授、武庫川女子大学薬学部 中瀬朋夏 教授らの研究グループは、がん細胞膜に穴を開けることなく超微量薬物を細胞内に導入することを可能にしました。その結果、がん細胞に対して細胞死を誘導するペプチドを細胞内へ高効率に取り込み、がん細胞死を生じさせることに成功しました。インクジェットプリンターの精密な液滴制御技術と、細胞膜通過を助ける膜透過性ペプチドとの組み合わせが成功の鍵となりました。さらに、分子量約15万の巨大分子である抗体でも、狙ったがん細胞群の細胞膜を通過させ、細胞内へ導入することができました。
本技術は細胞膜損傷が無く、熟練した技術も不要で、簡便かつ高効率に目的薬物を細胞内に届けることができます。またインクジェットシステムは、1滴がピコリットル(1兆分の1リットル)レベルで制御できるため超微量での吐出を可能にし、高価な薬物の使用量低減にもつながります。
1. 研究の背景
近年、創薬研究はますます盛んになっており、機能性タンパク質や核酸、人工高分子等の新しい薬物が日々生み出されています。しかしながら高分子薬を細胞膜通過させ、細胞内に導入することは難しく、多くの薬物は細胞の外に存在する生体分子を標的としています。
これまでの細胞内導入技術では、細胞に針を通して目的薬物を導入する方法や、細胞に高電圧をかけて細胞膜構造を不安定にしてから目的薬物を取り込ませる方法が代表的でした。これらの方法は確実性が高く細胞内導入効率が高い一方で、熟練した技術が必要で、かつ作業効率が低く、細胞生存率への影響が大きいこと等が問題視されています。
本研究チームはこれらの問題点を解決するため、簡便かつ細胞を傷つけない新たな細胞内導入技術として、インクジェットシステムと膜透過性ペプチドを用いた方法の開発を進めています。
近年、創薬研究はますます盛んになっており、機能性タンパク質や核酸、人工高分子等の新しい薬物が日々生み出されています。しかしながら高分子薬を細胞膜通過させ、細胞内に導入することは難しく、多くの薬物は細胞の外に存在する生体分子を標的としています。
これまでの細胞内導入技術では、細胞に針を通して目的薬物を導入する方法や、細胞に高電圧をかけて細胞膜構造を不安定にしてから目的薬物を取り込ませる方法が代表的でした。これらの方法は確実性が高く細胞内導入効率が高い一方で、熟練した技術が必要で、かつ作業効率が低く、細胞生存率への影響が大きいこと等が問題視されています。
本研究チームはこれらの問題点を解決するため、簡便かつ細胞を傷つけない新たな細胞内導入技術として、インクジェットシステムと膜透過性ペプチドを用いた方法の開発を進めています。
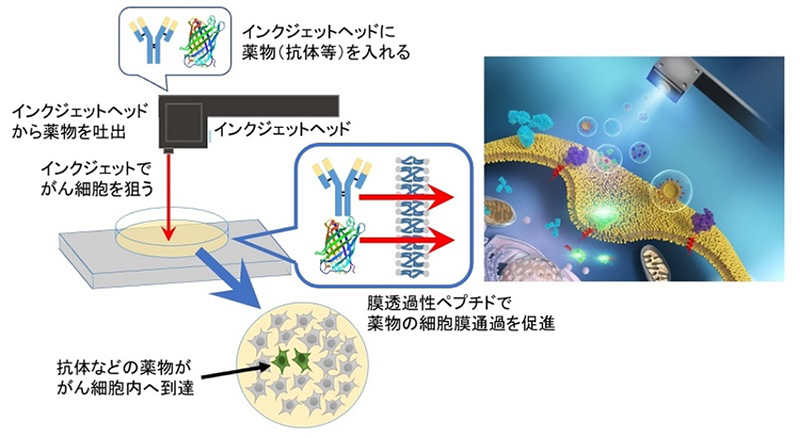
図1 : インクジェットシステムを活用したがん細胞内への薬物導入技術(概略図)
2. 研究の内容
本研究では、まず始めに、インクジェットシステム(クラスターテクノロジー株式会社製)を用いて蛍光標識したウイルス由来の膜透過性ペプチド(FHV coat (35-49))をインクジェットプリンターのインクカートリッジ部分に相当するヘッド部分に入れ、ヒト子宮頸がん由来HeLa細胞に吐出し、細胞内移行を観察しました。その結果、液滴の吐出スピードが増すほど、細胞膜通過および細胞内への移行効率が上昇することが確認できました。さらに、類表皮がんや乳がん細胞でも同様にFHVペプチドの高効率な細胞内移行を確認できました。このインクジェットシステムは、1滴をピコリットルレベルで制御できるだけでなく、1秒間で1,000回の連続高速吐出も可能です。また詳細な機序を今後調べる必要がありますが、本技術は、細胞膜を損傷させること無く目的分子が通過し、細胞内へ高効率に到達できるといった画期的な技術です。
次に、狙ったがん細胞群に細胞死を誘導させるため、PAD(pro-apoptotoc domain)ペプチドの細胞内導入実験を行いました。PADペプチドは細胞内に入ると、ミトコンドリアの膜を損傷させ、細胞死を誘導します。しかし、PADペプチドだけでは細胞内への移行効率がとても低く、抗がん剤として使えません。本研究では、PADペプチドにFHVペプチドを結合させ、さらにインクジェットシステムを用いた結果、高効率にがん細胞群に導入し細胞死を誘導することに成功しました。一方で、FHVペプチドを結合させていないPADペプチド単独の場合は、インクジェットを用いても導入効率が低く、細胞死を誘導できないことも確認しました。
さらに分子量が約15万といった巨大分子である抗体も、細胞膜を不安定化する膜透過性ペプチド(L17E)とインクジェットシステムを用いることで、がん細胞群に高効率で細胞膜通過し細胞内への導入が可能であることが確認できました。
本研究では、まず始めに、インクジェットシステム(クラスターテクノロジー株式会社製)を用いて蛍光標識したウイルス由来の膜透過性ペプチド(FHV coat (35-49))をインクジェットプリンターのインクカートリッジ部分に相当するヘッド部分に入れ、ヒト子宮頸がん由来HeLa細胞に吐出し、細胞内移行を観察しました。その結果、液滴の吐出スピードが増すほど、細胞膜通過および細胞内への移行効率が上昇することが確認できました。さらに、類表皮がんや乳がん細胞でも同様にFHVペプチドの高効率な細胞内移行を確認できました。このインクジェットシステムは、1滴をピコリットルレベルで制御できるだけでなく、1秒間で1,000回の連続高速吐出も可能です。また詳細な機序を今後調べる必要がありますが、本技術は、細胞膜を損傷させること無く目的分子が通過し、細胞内へ高効率に到達できるといった画期的な技術です。
次に、狙ったがん細胞群に細胞死を誘導させるため、PAD(pro-apoptotoc domain)ペプチドの細胞内導入実験を行いました。PADペプチドは細胞内に入ると、ミトコンドリアの膜を損傷させ、細胞死を誘導します。しかし、PADペプチドだけでは細胞内への移行効率がとても低く、抗がん剤として使えません。本研究では、PADペプチドにFHVペプチドを結合させ、さらにインクジェットシステムを用いた結果、高効率にがん細胞群に導入し細胞死を誘導することに成功しました。一方で、FHVペプチドを結合させていないPADペプチド単独の場合は、インクジェットを用いても導入効率が低く、細胞死を誘導できないことも確認しました。
さらに分子量が約15万といった巨大分子である抗体も、細胞膜を不安定化する膜透過性ペプチド(L17E)とインクジェットシステムを用いることで、がん細胞群に高効率で細胞膜通過し細胞内への導入が可能であることが確認できました。
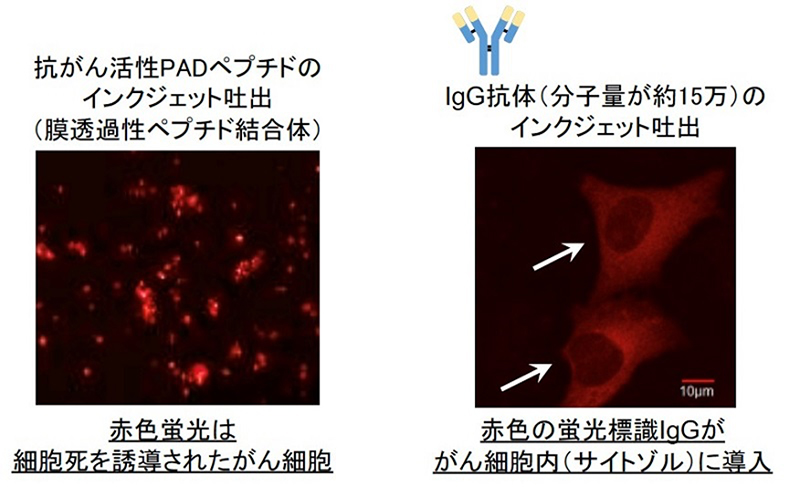
図2 : インクジェットシステムを活用したヒト子宮頸がん細胞への薬物導入例
(がん細胞内への抗がん活性PADペプチド(左)とIgG抗体(右)の送達)
(がん細胞内への抗がん活性PADペプチド(左)とIgG抗体(右)の送達)
3. 期待される効果・今後の展開
本研究成果は、基礎生物学研究から医学・薬学での臨床応用を見据えた、さまざまな薬物送達に応用可能な波及効果の高い技術になることが大いに期待できます。
さらに、これまで技術的に困難であった細胞内分子を標的とした高分子薬が幅広く応用でき、細胞膜内への導入が困難だった薬物も利用できるようになります。顕微鏡手術における狙った細胞群への薬物導入への適応等も考えられ、技術応用の広がりも期待できます。
本研究成果は、基礎生物学研究から医学・薬学での臨床応用を見据えた、さまざまな薬物送達に応用可能な波及効果の高い技術になることが大いに期待できます。
さらに、これまで技術的に困難であった細胞内分子を標的とした高分子薬が幅広く応用でき、細胞膜内への導入が困難だった薬物も利用できるようになります。顕微鏡手術における狙った細胞群への薬物導入への適応等も考えられ、技術応用の広がりも期待できます。
4. 研究プロジェクトについて
本研究の一部は、科学技術振興機構 戦略的創造研究推進事業(CREST)「細胞外微粒子に起因する生命現象の解明とその制御に向けた基盤技術の創出」(JPMJCR18H5)、京都大学化学研究所 国際共同利用・共同研究拠点(2022-85)、内藤記念科学振興財団、武田科学振興財団の支援のもとで行われました。
本研究の一部は、科学技術振興機構 戦略的創造研究推進事業(CREST)「細胞外微粒子に起因する生命現象の解明とその制御に向けた基盤技術の創出」(JPMJCR18H5)、京都大学化学研究所 国際共同利用・共同研究拠点(2022-85)、内藤記念科学振興財団、武田科学振興財団の支援のもとで行われました。
 京都大学 化学研究所
京都大学 化学研究所 国際共同利用・共同研究拠点
国際共同利用・共同研究拠点