2つの触媒と光エネルギーで未踏の化学反応を実現 ―医薬品・化学材料を迅速に組み上げる環境に優しい有機合成技術―
京都大学化学研究所 大宮寛久 教授らの研究グループは、光照射下、環境負荷の少ない有機触媒を2つ組み合わせて用いることで、これまで実現困難とされてきた、電子豊富な芳香族化合物のメタ位選択的なアシル化反応の開発に成功しました。
1877年にシャルル・フリーデルとジェームス・クラフツにより発見された、フリーデル・クラフツ反応は、芳香族化合物のベンゼン環上にアルキル基やアシル基のような有機基を導入する手法であり、医農薬や化学材料を組み上げる強力な化学反応です。ベンゼン環上に電子供与性基が置換した電子豊富な芳香族化合物を原料に用いたフリーデル・クラフツ反応は、電子供与性基のオルト位とパラ位に、有機基が選択的に導入されます。一方で、電子供与性基のメタ位に有機基を導入することは不可能でした。
本研究では、青色LED照射下、環境負荷の少ない有機触媒を2つ組み合わせて用いることで、電子供与性基の置換した電子豊富な芳香族化合物のメタ位選択的アシル化反応の開発に成功しました。これまで誰も到達できなかった、アンチ・フリーデル・クラフツ反応を開発したといえます。電子供与性基のメタ位に対して、完璧な選択性でアシル基の導入された芳香族化合物を各種つくりだすことが可能であり、医農薬や化学材料を迅速かつ効率的に組み上げる強力な有機合成技術につながります。また、光エネルギーと希少価値の高い金属元素を含まない有機触媒を利用しているため、環境に優しい有機合成技術として持続可能な社会の実現に貢献することも期待されます。

本研究の概要図:芳香族化合物のメタ位選択的アシル化反応
フリーデル・クラフツ反応は、1877年にシャルル・フリーデルとジェームス・クラフツにより発見され、有機化学の教科書にも掲載される、最も基本的な化学反応の一つです。具体的には、芳香族化合物のベンゼン環上にアルキル基やアシル基のような有機基を導入する手法であり、医農薬や化学材料を組み上げる強力な化学反応として知られています(図1上)。ベンゼン環上に電子供与性基が置換した電子豊富な芳香族化合物を原料に用いた、フリーデル・クラフツ反応は、電子供与性基のオルト位とパラ位に、有機基が選択的に導入されます。この現象をオルト/パラ配向性と言います。言い換えれば、電子供与性基のメタ位に有機基は導入されません。
このような背景のもと、遷移金属触媒を用いて、電子供与性基の置換した電子豊富な芳香族化合物のメタ位に有機基を導入する化学反応の開発が精力的に行われています。しかし、これら遷移金属触媒を用いた反応は、ベンゼン環上に、複雑な置換基やかさ高い置換基を導入した芳香族化合物を原料に用いる必要がありました。つまり、反応に利用できる原料に制限があることで、つくりだすことのできる芳香族化合物のバリエーションが乏しいといえます。また、触媒として金属塩を必要としていることから、より環境への負荷の少ない化学反応が求められます。

図1 :フリーデル・クラフツ反応と本研究成果の比較
研究グループは、青色LED照射下、環境負荷の少ない有機触媒を2つ組み合わせて活用することで、カルボン酸誘導体を用いた電子供与性基の置換した電子豊富な芳香族化合物のメタ位選択的なアシル化反応の開発に成功しました(図1下)。本研究の成功の鍵は、N-ヘテロ環カルベン触媒と有機光酸化還元触媒それぞれの触媒サイクルを協働的に機能させることで、望みのラジカル反応を意図的に制御した点といえます(図2)。
有機光酸化還元触媒(PC触媒)が可視光を吸収して高エネルギー状態(PC触媒*)に変化します。そして、このPC触媒*は、電子豊富な芳香族化合物から1電子を受け取り、カルボン酸誘導体とN-ヘテロ環カルベン触媒(NHC触媒)の反応から得られるアシルNHC中間体に1電子を渡します。このアシルNHC中間体は、1電子を受け取った後、ケチルラジカルになります。一方、カルボン酸誘導体とNHC触媒の反応において、カルボン酸誘導体から脱離したアゾリドアニオンが、1電子を奪われた電子豊富な芳香族化合物由来のラジカルカチオンと反応し、アルキルラジカルを与えます。こうして、これら反応系中に発生した2種類の異なるラジカル、ケチルラジカルとアルキルラジカルが反応することで、電子供与性基の置換した電子豊富な芳香族化合物のメタ位にアシル基が導入されます。
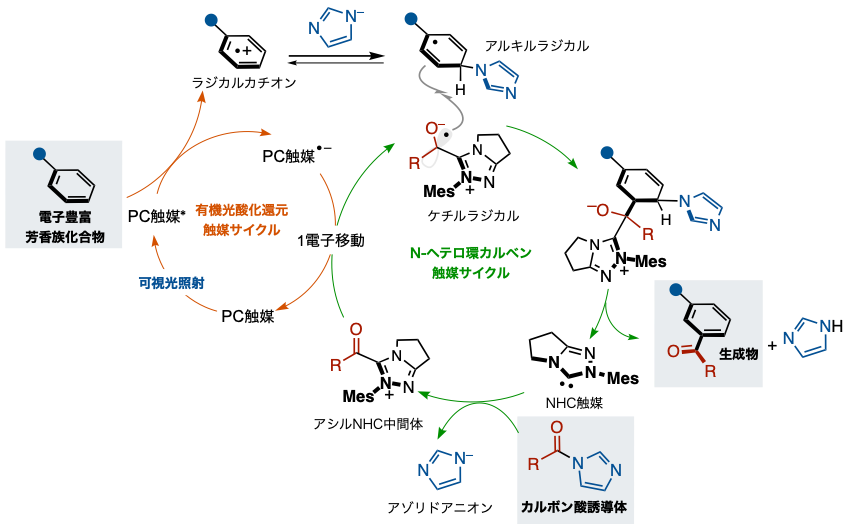
図2 :触媒サイクル
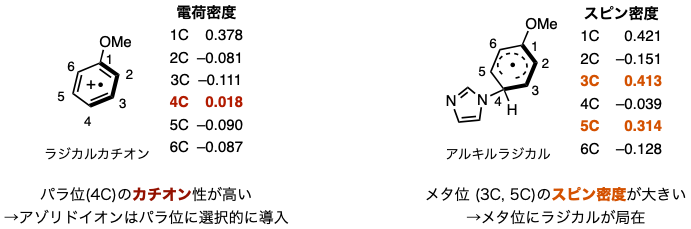
図3 :量子化学計算による機構研究
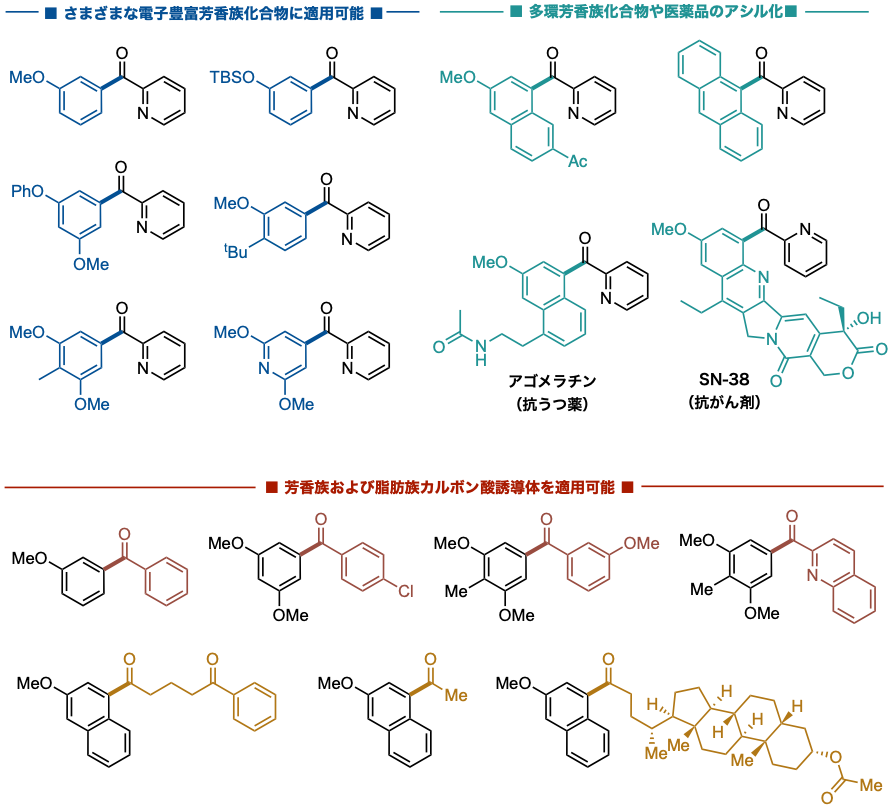
図4 :基質適用範囲
研究グループは、光照射下、環境負荷の少ない有機触媒を2つ組み合わせて用いることで、電子供与性基の置換した電子豊富な芳香族化合物のメタ位選択的なアシル化反応の開発に成功しました。これまで誰も到達できなかった、アンチ・フリーデル・クラフツ反応を開発したといえます。
本成果は、有機触媒を分子レベルで設計・操作することでラジカル反応を意図的に制御し、有機合成反応における新たな設計指針を打ち出したといえます。これまで到達困難であった芳香族化合物を迅速かつ高効率で供給することができ、医農薬や化学材料を組み上げる強力な有機合成技術になります。また、光エネルギーと希少価値の高い金属元素を含まない有機触媒を利用しているため、環境に優しい合成技術として持続可能な社会の実現に貢献することも期待されます。
本研究は、JSPS科学研究費補助金「基盤研究A(JP21H04681)」、「学術変革領域研究A 炭素資源変換を革新するグリーン触媒科学(JP23H004912)」、JST戦略的創造研究推進事業さきがけ「電子やイオン等の能動的制御と反応(JPMJPR19T2)」の支援を受けて実施されました。
●用語解説●
有機触媒:化学反応の際にそれ自身は変化せず、反応を進みやすくする触媒のうち、金属元素を含まず、炭素・水素・酸素・窒素・硫黄などの元素から成る、触媒作用を持つ低分子化合物。
メタ位:ベンゼン環上における、注目する置換基に対して隣の隣の位置(1位と3位の関係)。
アシル化反応:有機化合物に、カルボン酸から水酸基を取り除いた構造であるアシル基を導入する反応。
アルキル基:アルカンから水素原子を1個除いた炭化水素基の総称。
オルト位:ベンゼン環上における、注目する置換基に対して隣の位置(1位と2位の関係)。
パラ位:ベンゼン環上における、注目する置換基に対して反対側の位置(1位と4位の関係)。
遷移金属触媒:遷移金属と複数の原子団で構成される分子性触媒。
N-ヘテロ環カルベン触媒:炭素周りに電子が6つしかない化学種(カルベン)のうち、炭素原子の隣接位に窒素原子を持つ環状分子。
有機光酸化還元触媒:光を吸収して、他の分子との間で一電子酸化および一電子還元を引き起こす有機触媒のことを指す。
ケチルラジカル:ケトンが1電子を受け取って生成する、負電荷を有するラジカル種。
アゾリドアニオン:窒素を一つ以上含む五員環複素環化合物の負電荷を持つ化学種。
 京都大学 化学研究所
京都大学 化学研究所 国際共同利用・共同研究拠点
国際共同利用・共同研究拠点