ラジカルを活用した新たなケージド化法の開発 ―アセチルコリン濃度の時空間制御に成功―
京都大学化学研究所 大宮寛久 教授、同大学大学院薬学研究科 中村梨香子 博士後期課程1年、金沢大学ナノ生命科学研究所 新井敏 准教授、同大学医薬保健研究域薬学系 隅田有人 助教、同大学大学院新学術創成研究科 山崎健 博士後期課程2年 らの共同研究グループは、これまで実現困難であったアセチルコリンをケージド化する手法を開発し、生細胞条件およびハエの脳を用いたex vivo条件で自在にアセチルコリン濃度を制御することに成功しました。
ケージド化合物は、生理活性化合物に光で除去可能なユニット(Photoactivatable Protecting Group = PPG)の連結により一時的に不活化した分子で、まさにカゴ入れられたような状態です。光を照射することで、生理活性化合物が作用する時空間を制御できるため、この技術は細胞機能発現の機構解明に幅広く利用されています。一方で、ケージド化合物を作る際に汎用されるPPGは、その連結に水酸基(OH)やカルボキシル基(CO2H)あるいはアミノ基(NH)といった官能基が必要となります。つまり分子構造にこれらを持たない生理活性化合物はケージド化できないため、構造に制限がありました。
本研究では、可視光により炭素–ホウ素結合が切断されて炭素ラジカルが生じる有機ホウ素化合物を活用することで、分子骨格上の炭素を起点としたケージド化法を開発しました。炭素は全ての有機化合物に含まれるため、従来の構造制限を取り払うと期待されます。
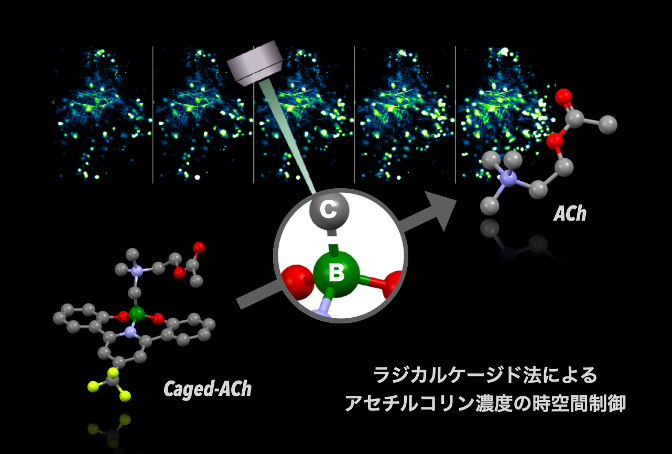
本研究の概要図 : ラジカルケージド法によるアセチルコリン濃度の時空間制御
光をトリガーとする生理活性化合物の活性発現は、タンパク質の機能を高い空間分解能で制御するための重要なツールです。中でも光で取り外しできる保護基(PPG)で分子機能を一時的に不活化したものはケージド化合物と呼ばれています。このケージド化合物を活用することで、たとえば、グルタミン酸受容体やGABA受容体のリガンドを光制御し、複雑な生物環境における機能性タンパク質の作用メカニズムや細胞内位置など光薬理学的研究が可能になりました。そのような背景のもと、低分子の神経伝達物質は作用機序解明の重要性からそのほとんどがケージド化され、イメージングツールとして生命科学研究に貢献してきました。しかし、ニトロベンジル基やクマリニル基、BODIPY基など広く使われるPPGは生理活性化合物との連結に、特定の求核的官能基(CO2H、 NH、 OHなど)が必要です。そのため、ケージド化したい生理活性化合物には特定の官能基が必要であり、これがターゲットとなる分子構造の制限となっていました。例えばアセチルコリン(ACh)は、歴史上はじめて見出された神経伝達物質にも関わらず、その構造の単純さから「とっかかり」がなく、ケージドAChは未達成でした。
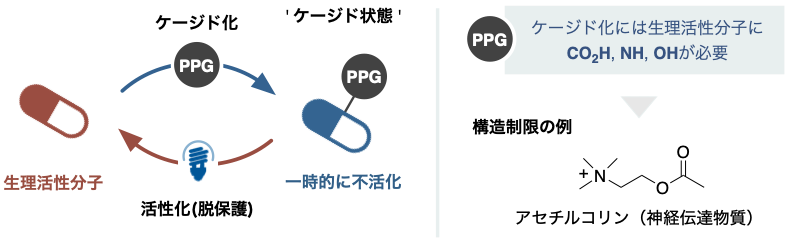
図1 : 光ケージド化法の概略図と従来法の適用制限
研究グループは、先行研究において可視光で炭素–ホウ素結合が均等開裂して炭素ラジカルが発生する有機ホウ素化合物を見出し、報告しています(図2上)。そこでアミンなどと簡単に置換反応を起こすヨウ素基を持つ有機ホウ素化合物を設計しました。この分子に第三級アミンを反応させることで、窒素原子にホウ素メチル基が導入されたベタイン構造が得られます。この分子に可視光照射するとホウ素上から炭素ラジカルが切り離され、生じた炭素ラジカルが水素を獲得することで活性なベタイン構造となります(図2下)。
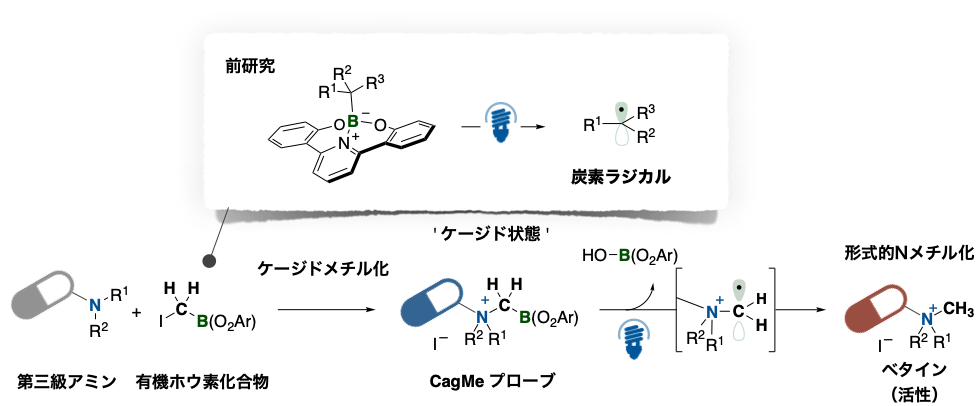
図2 : 可視光励起できるホウ素化合物(前研究)を利用したケージド戦略
本戦略に基づいて、前駆体となる第三級アミンとPPGとなる有機ホウ素化合物を連結することで、ケージドAChの合成を達成しました。このとき、PPGへのCF3基の導入により吸収波長の長波長化および切断速度の向上が見られました(図3A)。またLEDライトだけでなく共焦点顕微鏡レーザー(405 nm)でも切断・放出が実現できたため、実際に細胞でのプローブとして実験を行いました。表面にAChを感知して光るセンサータンパク質(図3B)を発現させた細胞を準備し、開発したケージドACh(CagMeCF3-ACh)を添加しました。共焦点顕微鏡レーザーを照射したところ、有意に輝度が向上しました(図3C)。
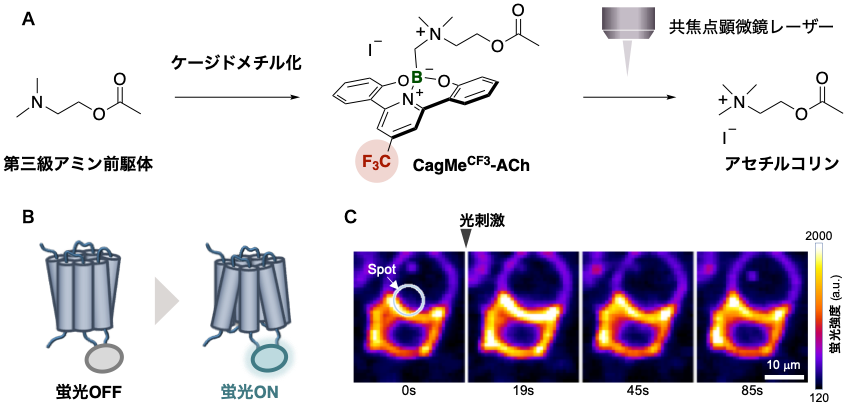
図3 : (A)ケージドAChの合成(B)AChセンサータンパク質(C)ACh濃度変化モニタリング
次に本プローブをショウジョウバエの脳を用いて、ライブイメージングを行いました。Ca2+イオンセンサーであるjGCaMP7cを発現したトランスジェニックショウジョウバエを準備し、その脳をスライスしてケージドプローブとインキュベートしました。その後、細胞実験と同様にレーザーを照射したところ、視神経葉やキノコ体領域でCa2+イオンの明確な増加が観測されました。以上より、本研究グループが開発したプローブは、光によるACh濃度の時空間制御を可能にしました。
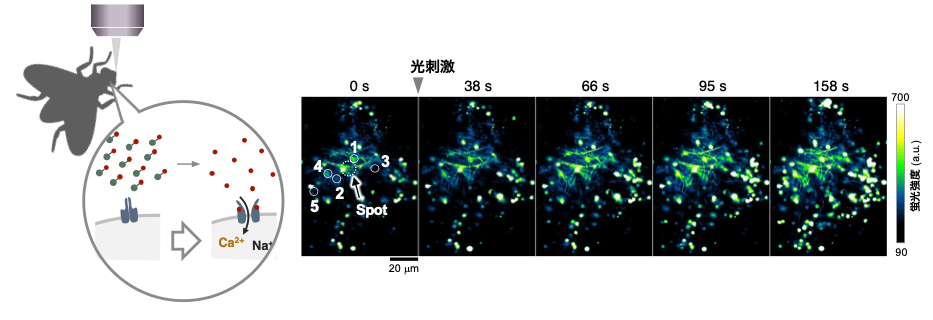
図4 : ハエの脳を用いたex vivoイメージング
本研究で開発した手法は、従来困難であった炭素上でのケージド化を実現し、結果としてケージドAChの任意の時空間での発生を可能にしました。ケージドAChの開発により、これまで間接的な評価で行われてきたAChの細胞機能に対する挙動がより厳密に評価できると期待されます。本手法は、今回標識したベタイン構造以外にも、AChと同様に従来の手法では困難であった生理活性化合物のケージド化を可能にする潜在性を秘めています。ケージド化できる生理活性化合物の大幅な拡大は、イメージングツールとして今後の光薬理学研究を推進するものと期待されます。
本研究は科研費JP21H04681、JP21K06474、JP21K19044、JP22H05351、JP23H04912、金沢大学先魁プロジェクト2020、2022、持田記念医学薬学振興財団、旭硝子財団、武田科学振興財団、JST戦略的創造研究推進事業さきがけ「電子やイオン等の能動的制御と反応(JPMIPR19T2)」、京都大学化学研究所国際共同利用・共同拠点 (grant 2023-19)、金沢大学WPI Nano LSIの支援を受けて実施されました。
●用語解説●
アセチルコリン:神経伝達物質の一種であり、情報伝達や筋肉制御に関与する。神経細胞の終末から放出され、シナプスを介して隣接する神経細胞との間で信号を伝達する。
ケージド化:生理活性化合物を光で分解可能な保護基で保護し、一時的に生理活性を不活化する手法。
ex vivo:生体から直接採取された組織を用いた試験や実験。
PPG:Photoactivatable Protecting Groupの略であり、光ケージドに用いられる特定の波長によって切断・除去が可能なユニット
BODIPY:BOron-DIPYrrometheneの略であり、蛍光色素の一種。特徴として周辺環境に依存しない高い蛍光量子収率を示す。
均等開裂:二電子によって形成されている共有結合が均等に切断する化学結合開裂の一種。
ベタイン:四級アンモニウム化合物を含む正電荷と負電荷を同一分子内の隣り合わない位置に持つ化合物群。
jGCaMP7c:GFP(緑色蛍光タンパク質)とカルシウム結合ドメインを組み合わせたセンサータンパク質であり、蛍光強度の変化によってCa2+イオンの動態を可視化できる。
 京都大学 化学研究所
京都大学 化学研究所 国際共同利用・共同研究拠点
国際共同利用・共同研究拠点