ニトロゲナーゼ活性中心への硫黄原子導入過程の解析–窒素固定を支える含硫黄小分子の発見–
本研究成果は、2021年10月11日、に国際学術誌「Nature Chemistry」のオンライン版に掲載されました。
京都大学化学研究所の谷藤一樹助教(カリフォルニア大学アーバイン校アシスタントプロジェクトサイエンティスト、当時)、大木靖弘教授とカリフォルニア大学アーバイン校のMarkus W. Ribbe教授、Yilin Hu教授、カリフォルニア大学デービス校のR. David Britt教授、スタンフォード大学のKeith O. Hodgson教授、Britt Hedman教授、ローレンスバークレー国立研究所のJan Kern博士、矢野淳子博士、ウィスコンシン大学ミルウォーキー校のJarett Wilcoxen助教授らの共同研究チームは、窒素還元酵素(ニトロゲナーゼ)の触媒活性中心となる金属-硫黄補酵素が、その生合成過程において亜硫酸イオン(SO32–)から硫黄原子を取り込む様子を明らかにしました。
1. 背景
窒素(N)は、アミノ酸やRNA、DNAといった分子に含まれる、生命活動に欠かせない元素です。この元素は窒素ガス(N2)として私達の身の回りに豊富に存在しますが、多くの生物は非常に安定なN2を窒素源として用いることができません。自然界では窒素固定細菌と呼ばれる微生物が、窒素還元酵素(ニトロゲナーゼ)を用いてN2から生物が利用可能な窒素源(アンモニアなど)を生み出し、生態系を支えています。また窒素の供給は効率的な食料生産に不可欠であるため、生産性の高い窒素固定法を目指して、細胞、遺伝子、タンパク質レベルでニトロゲナーゼを利用しようとする研究が世界中で行われています。しかしながら、鉄-モリブデン-硫黄-炭素からなるニトロゲナーゼの触媒活性中心(FeMocoまたはM-cluster, 図1)参考文献1 は、複数のタンパク質が複雑に絡む反応を経て作られており、その合成に必要な材料(生体分子)すら未だ完全に明らかではありません。
窒素(N)は、アミノ酸やRNA、DNAといった分子に含まれる、生命活動に欠かせない元素です。この元素は窒素ガス(N2)として私達の身の回りに豊富に存在しますが、多くの生物は非常に安定なN2を窒素源として用いることができません。自然界では窒素固定細菌と呼ばれる微生物が、窒素還元酵素(ニトロゲナーゼ)を用いてN2から生物が利用可能な窒素源(アンモニアなど)を生み出し、生態系を支えています。また窒素の供給は効率的な食料生産に不可欠であるため、生産性の高い窒素固定法を目指して、細胞、遺伝子、タンパク質レベルでニトロゲナーゼを利用しようとする研究が世界中で行われています。しかしながら、鉄-モリブデン-硫黄-炭素からなるニトロゲナーゼの触媒活性中心(FeMocoまたはM-cluster, 図1)参考文献1 は、複数のタンパク質が複雑に絡む反応を経て作られており、その合成に必要な材料(生体分子)すら未だ完全に明らかではありません。
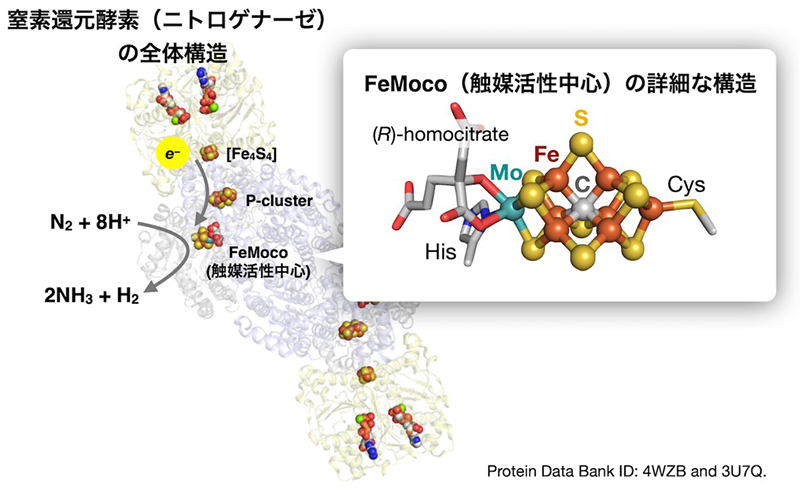
図1:窒素還元酵素(ニトロゲナーゼ)とその触媒活性中心(FeMoco)の構造。図はProtein Data Bank(ID: 4WZB, 3U7Q)より該当部分を抜粋して作成した。
2. 成果
研究チームはこれまでにFeMocoの生合成を試験管内で再現することに成功し、タンパク質と合成無機化合物を組み合わせたユニークな手法により、その過程を分子レベルで詳らかにしてきました。本研究の足がかりとなった以前の報告参考文献2 では、FeMocoの前駆体となる鉄-硫黄-炭素クラスター(L-cluster)が、2つのサイコロ型鉄-硫黄クラスター([Fe4S4]-cluster)を出発に、炭素(C)原子と硫黄(S)原子を段階的に取り込んで生成することを明らかにしています(図2)。L*-clusterと名付けた中間体(図2右上)を経て、次のステップで導入されるS原子は、亜硫酸イオン(SO32–)に由来する「らしい」という実験結果はあるものの、決定的な証拠は得られていませんでした。
研究チームはこれまでにFeMocoの生合成を試験管内で再現することに成功し、タンパク質と合成無機化合物を組み合わせたユニークな手法により、その過程を分子レベルで詳らかにしてきました。本研究の足がかりとなった以前の報告参考文献2 では、FeMocoの前駆体となる鉄-硫黄-炭素クラスター(L-cluster)が、2つのサイコロ型鉄-硫黄クラスター([Fe4S4]-cluster)を出発に、炭素(C)原子と硫黄(S)原子を段階的に取り込んで生成することを明らかにしています(図2)。L*-clusterと名付けた中間体(図2右上)を経て、次のステップで導入されるS原子は、亜硫酸イオン(SO32–)に由来する「らしい」という実験結果はあるものの、決定的な証拠は得られていませんでした。
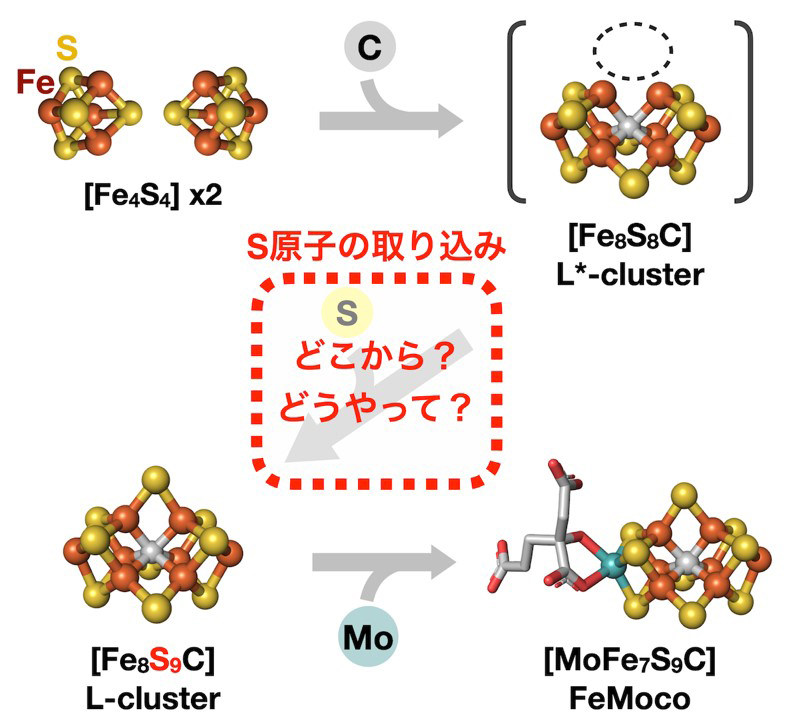
図2:研究チームが提案したFeMocoの生合成過程と本研究のターゲットであるS原子の取り込みステップの模式図。L*-clusterからL-clusterを生成する際に亜硫酸イオン(SO32–)から硫黄を取り込むと提案していたが、決定的な証拠に欠けていた。
本研究で対象となったC原子、S原子の取り込みを伴うL-clusterへの変換はNifBと呼ばれるタンパク質上で起こります。そこでチームは、NifBとSO32–に似た化合物である亜セレン酸イオン(SeO32–)や亜テルル酸イオン(TeO32–)を用いて、取り込まれるS原子をセレン(Se)やテルル(Te)で置き換えようと考えました(図3)。SeやTeはタンパク質中にほとんど存在しないため、取り込まれた原子だけを選択的に観測できます。実際にSe/Te原子の取り込みを酵素活性によって評価したところ、S原子の場合と同等の効率で起こることが確認でき、Se/Teによってラベル化したL-clusterは電子スピン共鳴スペクトルによって同定できました。こうして導入したSe/Te原子は、X線吸収分光を使ってクラスターの鉄と結合している様子を観察し、それぞれSe2–/Te2–の状態に還元されていることを支持する結果を得ました。さらに、理論計算を用いてSO32–/SeO32–/TeO32–が取り込まれる過程をシミュレーションしたところ、これらのイオンがL-cluster上でS2–/Se2–/Te2–まで還元される反応が、実際に起こりうるという結果も得られました。
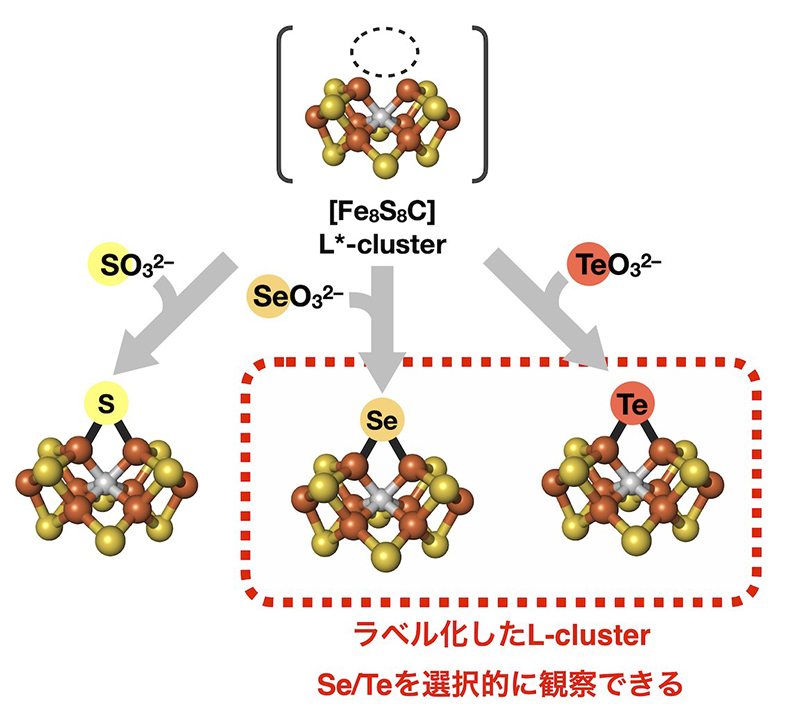
図3:本研究で開発したS原子のSe/Te原子によるラベル化手法の模式図。反応はNifBと呼ばれるタンパク質において起こり、ラベル化したL-clusterが生成していることは酵素活性測定、電子スピン共鳴スペクトル、X線吸収分光を用いて確認した。
以上のように、本研究では生化学、分光学、理論化学を複合的に組み合わせたアプローチによって、FeMocoがその生合成過程においてSO32–からS原子を取り込む様子を明らかにしました。これらの結果は、チームが提案してきた「L-clusterがSO32–を還元してS原子を取り込む」という仮説を強力にサポートするものです。
3. 今後の展望
SeやTeによってラベル化されたL-clusterは、さらにFeMocoへ誘導することで、取り込まれた原子がN2を還元する際にどのように振る舞うかを観察できると考えられます。また、本研究で提案したL-clusterによるSO32–の還元は、FeMocoがN2を還元してNH3を放出する過程にも関わると考えられ、チームは一層の研究を進めています。さらに、ニトロゲナーゼが機能するためにS源が必須である、という事実は細胞内での窒素固定が硫黄の代謝経路と密接に関わることを示唆します。つまり細胞レベルで窒素固定システムを利用するには、このS源も考慮に入れる必要があると考えられ、関連する代謝工学や合成生物学にも有用な知見と言えます。
SeやTeによってラベル化されたL-clusterは、さらにFeMocoへ誘導することで、取り込まれた原子がN2を還元する際にどのように振る舞うかを観察できると考えられます。また、本研究で提案したL-clusterによるSO32–の還元は、FeMocoがN2を還元してNH3を放出する過程にも関わると考えられ、チームは一層の研究を進めています。さらに、ニトロゲナーゼが機能するためにS源が必須である、という事実は細胞内での窒素固定が硫黄の代謝経路と密接に関わることを示唆します。つまり細胞レベルで窒素固定システムを利用するには、このS源も考慮に入れる必要があると考えられ、関連する代謝工学や合成生物学にも有用な知見と言えます。
4. 研究プロジェクトについて
本研究は、科学研究費補助金、武田科学振興財団、立松財団、京都大学化学研究所国際共同利用・共同研究拠点、米国National Institute of Health-National Institute of General Medical Sciences(NIH-NIGMS)グラントの支援によって行われました。また、測定に利用したSLAC National Accelerator Laboratoryは米国Department of Energy(DOE)の、Stanford Synchrotron Radiation Lightsourceの構造生物学プログラムはDOEならびにNIH-NIGMSの支援によって運営されています。
本研究は、科学研究費補助金、武田科学振興財団、立松財団、京都大学化学研究所国際共同利用・共同研究拠点、米国National Institute of Health-National Institute of General Medical Sciences(NIH-NIGMS)グラントの支援によって行われました。また、測定に利用したSLAC National Accelerator Laboratoryは米国Department of Energy(DOE)の、Stanford Synchrotron Radiation Lightsourceの構造生物学プログラムはDOEならびにNIH-NIGMSの支援によって運営されています。
参考文献
[1] (a) Lancaster, K. M.; Roemelt, M.; Ettenhuber, P.; Hu, Y.; Ribbe, M. W.; Neese, F.; Bergmann, U.; DeBeer, S., Science, 2011, 334, 974–977. (b) Spatzal, T.; Aksoyoglu, M.; Zhang, L.; Andrade, S. L. A.; Schleicher, E.; Weber, S.; Rees, D. C.; Einsle, O., Science, 2011, 334, 940.
[2] 例えば, (a) Tanifuji, K.; Lee, C. C.; Sickerman, N. S.; Tatsumi, K.; Ohki, Y.; Hu, Y.; Ribbe, M. W., Nat. Chem., 2018, 10, 568–572. (b) Jasniewski, A. J.; Wilcoxen, J.; Tanifuji, K.; Hedman, B.; Hodgson, K. O.; Britt, R. D.; Hu, Y.; Ribbe, M. W. Angew., Chem. Int. Ed., 2019, 58, 14703–14707. など.
[1] (a) Lancaster, K. M.; Roemelt, M.; Ettenhuber, P.; Hu, Y.; Ribbe, M. W.; Neese, F.; Bergmann, U.; DeBeer, S., Science, 2011, 334, 974–977. (b) Spatzal, T.; Aksoyoglu, M.; Zhang, L.; Andrade, S. L. A.; Schleicher, E.; Weber, S.; Rees, D. C.; Einsle, O., Science, 2011, 334, 940.
[2] 例えば, (a) Tanifuji, K.; Lee, C. C.; Sickerman, N. S.; Tatsumi, K.; Ohki, Y.; Hu, Y.; Ribbe, M. W., Nat. Chem., 2018, 10, 568–572. (b) Jasniewski, A. J.; Wilcoxen, J.; Tanifuji, K.; Hedman, B.; Hodgson, K. O.; Britt, R. D.; Hu, Y.; Ribbe, M. W. Angew., Chem. Int. Ed., 2019, 58, 14703–14707. など.
●用語解説●
電子スピン共鳴:磁場の影響下におかれた不対電子がマイクロ波を吸収する現象を用いて、不対電子の検出とその電子が置かれた環境について情報を得る分光法。ニトロゲナーゼのように複数の金属と硫黄からなるクラスターを持つタンパク質に対して、クラスターの構造や酸化状態を知る手法として広く用いられている。
X線吸収分光:X線の吸収に伴う内殻電子の励起を利用して、物質の電子状態や局所構造を知るために用いられる分光法。本研究では特にFe、Se、Teについて測定を行い、得られたデータを統合することでL-clusterに導入されたSe、Te原子に関する情報を得た。高強度のX線を必要とするため、通常はシンクロトロン放射光施設を利用して測定が行われる。
 京都大学 化学研究所
京都大学 化学研究所 国際共同利用・共同研究拠点
国際共同利用・共同研究拠点