抗体を液滴に濃縮し細胞内へ高速輸送 —クモ毒改良ペプチドと抗体による液—液相分離の誘起と抗体の細胞内輸送—
本研究成果は2021年6月11日付で、Very Important Paper (VIP、上位5%の重要論文)として国際学術誌「Angewandte Chemie International Edition」にてオンライン掲載されました。
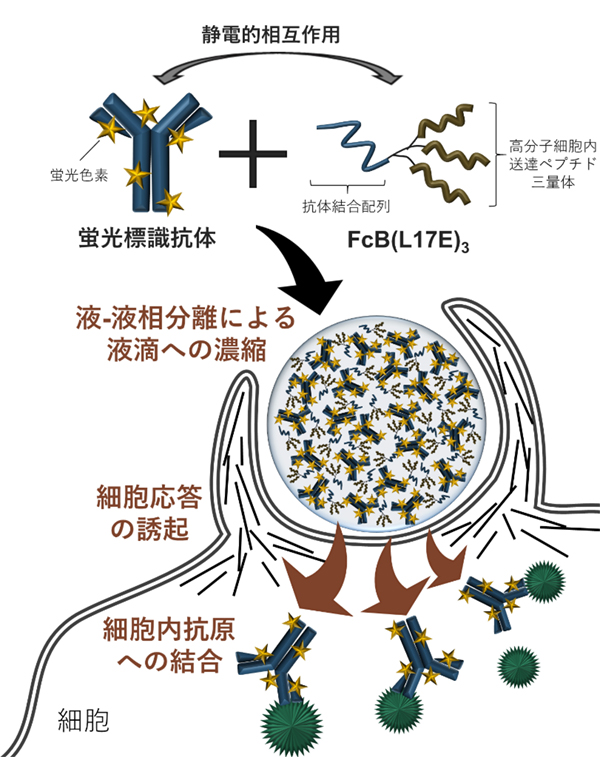
京都大学化学研究所の二木史朗 教授らの研究グループは、液―液相分離を活用して、抗体などのタンパク質と高分子細胞内送達ペプチドを液滴内に濃縮することで、細胞内に効果的に輸送する手法を開発しました。
液―液相分離とは、水中に存在する高分子が相互作用により集合し、高分子を多く含む相と希薄な相の2相に分かれる現象です。この時、高分子を多く含む相は水中に漂う液滴状に観察されます。近年、この現象は細胞の生命活動において重要な役割を担っていることが分かり、細胞生物学の分野において盛んに研究が行われています。一方で、薬物送達の分野においても、この液―液相分離により形成される液滴が新たな薬物キャリアとして注目を集めています。しかし、これまでに抗体のようなサイズの大きなタンパク質の細胞内輸送を達成した報告はありませんでした。抗体を含むバイオ医薬品はこれまでの低分子医薬品にない優れた特性や治療効果を示すものとして世界中で開発が進められており、細胞内への効果的な輸送方法が模索されています。本研究では蛍光色素により標識されることで負電荷性を持った抗体が、正電荷性を持つ高分子送達ペプチドFcB(L17E)3と静電的相互作用により液―液相分離を引き起こすことを見出し、さらには形成された液滴中に高分子送達ペプチドが含まれることで濃縮されたタンパク質が効率的に細胞内へ移行することを明らかにしました。この現象の発見により、今後、液―液相分離を応用した新たな薬物キャリアの開発が加速されると期待されます。
1. 背景
抗体は優れた抗原認識能を有しており、生命科学分野において特定の分子解析ツールとして用いられているだけでなく、分子標的薬としての開発が進んでいます。しかし抗体は自身のサイズ (約150 kDa) が大きく、親水性も高いことから、そのままでは細胞を覆う脂質バリアである細胞膜を透過することができません。そのため、生細胞内分子を標的にすることは一般に困難です。抗体の医薬品としての適用においても、その標的は細胞外分子に限られています。抗体を効率よく生細胞内に送達する手法を開発することができれば、細胞生物学の基礎研究に大きなインパクトを与えるだけでなく、抗体医薬品の適用を細胞内因子にまで拡張することが可能になると期待されます。
二木教授らの研究グループは以前に、クモ毒由来の溶血性ペプチドM-lycotoxinの配列を改変した高分子細胞内送達ペプチドL17Eを開発しました。L17Eの開発により、抗体を含むバイオ高分子を細胞内に導入することが可能になりました。しかし、L17Eの十分な活性を得るためには高濃度のL17Eと抗体が必要です。 細胞生物学などの基礎研究への適用や臨床応用を見据えると、細胞内送達に必要なL17Eと抗体がより低濃度で、より効率的に細胞内に送達できることが求められます。
抗体は優れた抗原認識能を有しており、生命科学分野において特定の分子解析ツールとして用いられているだけでなく、分子標的薬としての開発が進んでいます。しかし抗体は自身のサイズ (約150 kDa) が大きく、親水性も高いことから、そのままでは細胞を覆う脂質バリアである細胞膜を透過することができません。そのため、生細胞内分子を標的にすることは一般に困難です。抗体の医薬品としての適用においても、その標的は細胞外分子に限られています。抗体を効率よく生細胞内に送達する手法を開発することができれば、細胞生物学の基礎研究に大きなインパクトを与えるだけでなく、抗体医薬品の適用を細胞内因子にまで拡張することが可能になると期待されます。
二木教授らの研究グループは以前に、クモ毒由来の溶血性ペプチドM-lycotoxinの配列を改変した高分子細胞内送達ペプチドL17Eを開発しました。L17Eの開発により、抗体を含むバイオ高分子を細胞内に導入することが可能になりました。しかし、L17Eの十分な活性を得るためには高濃度のL17Eと抗体が必要です。 細胞生物学などの基礎研究への適用や臨床応用を見据えると、細胞内送達に必要なL17Eと抗体がより低濃度で、より効率的に細胞内に送達できることが求められます。
2. 研究手法・成果
この実現をめざし、同研究グループは、L17Eの多量体化と抗体との複合体形成によりこの問題の解決をはかることを意図し、抗体のFc領域に結合するL17Eの三量体、FcB(L17E)3というペプチドを作製しました。
まず、FcB(L17E)3による抗体の細胞内送達能がL17Eと比較してどれだけ向上するかについて評価しました。顕微鏡を用いて観察をするために抗体には蛍光色素による標識を行いました。結果として、FcB(L17E)3は、細胞内送達の際に必要な抗体量を、L17Eを用いた場合の約1/10に低減できることが分かりました。
続いて同研究グループは、この効果的な細胞内送達を達成する作用様式を検討しました。FcB(L17E)3と抗体の各1分子からなる複合体による細胞内移行することを当初想定していましたが、実際にFcB(L17E)3と蛍光標識抗体の混合溶液を観察すると、溶液中で多くの分子が集合することで、濃縮され、溶液中の他の領域とは分離した2 μmほどの液滴を形成していることが分かりました。詳細な検討により、この液滴が静電的相互作用を駆動力とした液―液相分離によるものであることが明らかになりした。FcB(L17E)3による蛍光標識抗体の細胞内への移行の様子を経時的に観察したところ、形成された液滴から大量の蛍光標識抗体が細胞内へと一挙に流入する様子を捉えることができました。細胞内へ送達された抗体の細胞内標的タンパク質の認識能も保持されていることも示されました。
以上に加えて、今回の研究では、FcB(L17E)3と(-30)GFPという負電荷性の緑色蛍光タンパク質との静電的相互作用により、蛍光標識抗体の場合と同様の現象を観察することができました。さらには、(-30)GFPを負電荷性のタグとして他の機能性タンパク質に付与することで、FcB(L17E)3により細胞内へ送達し、その機能を発揮させることに成功しています。
近年、液―液相分離は細胞内の生命現象を解き明かす重要な鍵として、細胞生物学分野において盛んに研究が行われています。さらには液―液相分離により形成される液滴の核酸などの細胞内送達への適用も報告され、液―液相分離は薬物送達に新しい潮流を生み出す方法論としても興味を持たれています。しかし、液―液相分離を活用した薬物キャリアの研究は現在黎明期であり、特に機能を持ったタンパク質の細胞内送達は実現されていませんでした。原因の一つとして、ただ液滴が形成されるだけでは効率的な内包物の細胞内への放出ができないことが挙げられます。今回、偶然にも発見された高分子細胞内送達ペプチドと負電荷性タンパク質により形成された液滴による、効率的なタンパク質の細胞内送達手法は、今後の液―液相分離を応用した薬物キャリアのデザイン戦略に新しい設計指針を与えることになると期待されます。
この実現をめざし、同研究グループは、L17Eの多量体化と抗体との複合体形成によりこの問題の解決をはかることを意図し、抗体のFc領域に結合するL17Eの三量体、FcB(L17E)3というペプチドを作製しました。
まず、FcB(L17E)3による抗体の細胞内送達能がL17Eと比較してどれだけ向上するかについて評価しました。顕微鏡を用いて観察をするために抗体には蛍光色素による標識を行いました。結果として、FcB(L17E)3は、細胞内送達の際に必要な抗体量を、L17Eを用いた場合の約1/10に低減できることが分かりました。
続いて同研究グループは、この効果的な細胞内送達を達成する作用様式を検討しました。FcB(L17E)3と抗体の各1分子からなる複合体による細胞内移行することを当初想定していましたが、実際にFcB(L17E)3と蛍光標識抗体の混合溶液を観察すると、溶液中で多くの分子が集合することで、濃縮され、溶液中の他の領域とは分離した2 μmほどの液滴を形成していることが分かりました。詳細な検討により、この液滴が静電的相互作用を駆動力とした液―液相分離によるものであることが明らかになりした。FcB(L17E)3による蛍光標識抗体の細胞内への移行の様子を経時的に観察したところ、形成された液滴から大量の蛍光標識抗体が細胞内へと一挙に流入する様子を捉えることができました。細胞内へ送達された抗体の細胞内標的タンパク質の認識能も保持されていることも示されました。
以上に加えて、今回の研究では、FcB(L17E)3と(-30)GFPという負電荷性の緑色蛍光タンパク質との静電的相互作用により、蛍光標識抗体の場合と同様の現象を観察することができました。さらには、(-30)GFPを負電荷性のタグとして他の機能性タンパク質に付与することで、FcB(L17E)3により細胞内へ送達し、その機能を発揮させることに成功しています。
近年、液―液相分離は細胞内の生命現象を解き明かす重要な鍵として、細胞生物学分野において盛んに研究が行われています。さらには液―液相分離により形成される液滴の核酸などの細胞内送達への適用も報告され、液―液相分離は薬物送達に新しい潮流を生み出す方法論としても興味を持たれています。しかし、液―液相分離を活用した薬物キャリアの研究は現在黎明期であり、特に機能を持ったタンパク質の細胞内送達は実現されていませんでした。原因の一つとして、ただ液滴が形成されるだけでは効率的な内包物の細胞内への放出ができないことが挙げられます。今回、偶然にも発見された高分子細胞内送達ペプチドと負電荷性タンパク質により形成された液滴による、効率的なタンパク質の細胞内送達手法は、今後の液―液相分離を応用した薬物キャリアのデザイン戦略に新しい設計指針を与えることになると期待されます。
3. 波及効果、今後の予定
今回の研究で、負電荷性のタンパク質を高分子送達ペプチドとともに液滴に濃縮することで効率に細胞内へ送達できることが明らかになりました。細胞内の分子を認識・結合するタンパク質を導入することで、細胞内の可視化や細胞内分子の活性制御が可能になると考えられ、新たな生命科学研究ツールとしての利用が期待されます。特に、機能性タンパク質の導入によって、細胞内分子の活性制御が可能となれば、従来の小分子では標的とすることが困難であったものを含む様々な細胞内分子も標的とすることができる可能性があります。これにより、今までは困難であった難治性疾患の新たな治療法開発につながる可能性があります。
現状では、送達するタンパク質は負に帯電している必要があるため汎用性が高くないのが課題です。課題の克服を含め、液―液相分離を活用し、実用的で、様々なタンパク質へ応用できる細胞内へのタンパク質送達手法の開発を目指します。
今回の研究で、負電荷性のタンパク質を高分子送達ペプチドとともに液滴に濃縮することで効率に細胞内へ送達できることが明らかになりました。細胞内の分子を認識・結合するタンパク質を導入することで、細胞内の可視化や細胞内分子の活性制御が可能になると考えられ、新たな生命科学研究ツールとしての利用が期待されます。特に、機能性タンパク質の導入によって、細胞内分子の活性制御が可能となれば、従来の小分子では標的とすることが困難であったものを含む様々な細胞内分子も標的とすることができる可能性があります。これにより、今までは困難であった難治性疾患の新たな治療法開発につながる可能性があります。
現状では、送達するタンパク質は負に帯電している必要があるため汎用性が高くないのが課題です。課題の克服を含め、液―液相分離を活用し、実用的で、様々なタンパク質へ応用できる細胞内へのタンパク質送達手法の開発を目指します。
4. 研究プロジェクトについて
本研究はJSPS科学研究費補助金(JP18H04017, JP20H04707, JP21H04794)とJST CREST (JPMJCR18H5)の支援を受けました。
本研究はJSPS科学研究費補助金(JP18H04017, JP20H04707, JP21H04794)とJST CREST (JPMJCR18H5)の支援を受けました。
 京都大学 化学研究所
京都大学 化学研究所 国際共同利用・共同研究拠点
国際共同利用・共同研究拠点