自己集合性ワクチンアジュバントの発見
京都大学化学研究所 上杉志成 教授(兼 同大学アイセムス連携主任研究者・副拠点長)、同大学アイセムス ダニエル・パックウッド 講師、東京大学医科学研究所 石井健 教授、大阪大学微生物病研究所・免疫学フロンティア研究センター 山崎晶 教授、京都大学化学研究所 倉田博基 教授、時任宣博 教授らの研究グループは、工業生産可能な新しいタイプのワクチンアジュバントを発見しました。
臨床応用されている多くのワクチンにはアジュバントとよばれる補助剤が必要であり、アジュバントによってワクチンの作用が増強され持続します。しかし、臨床応用されているアジュバントの数は少ないという課題があります。新興ウイルスなどの新しい病原体に適したアジュバントを選択するには、多種のアジュバントを準備する必要があります。
免疫応答やアジュバント活性には、物質の大きさが関与しています。上杉教授らは8,000個の化学物質の中から水中で自己集合して巨大化する化合物を選び、その中からワクチンアジュバント活性のある化合物を見いだしました。その化合物の類縁体を化学合成することによって強力なアジュバント活性をもつ化合物を発見し、コリカマイドと名付けました。
コリカマイドは自己集合してウイルスに似た大きさと形状になり、免疫細胞に取り込まれ、Toll-like receptor 7というウイルス受容体に認識されます。いわば、ウイルスになりすまして免疫細胞を活性化するのです。マウスにインフルエンザワクチンと共に投与すると、インフルエンザワクチンの効果を増強し、マウスがインフルエンザに耐えうるようになりました。コリカマイドは化学構造が単純であり、工業化が可能です。今後、コリカマイドやその類縁体は新興ウイルスワクチンのアジュバントとして応用されると期待されます。
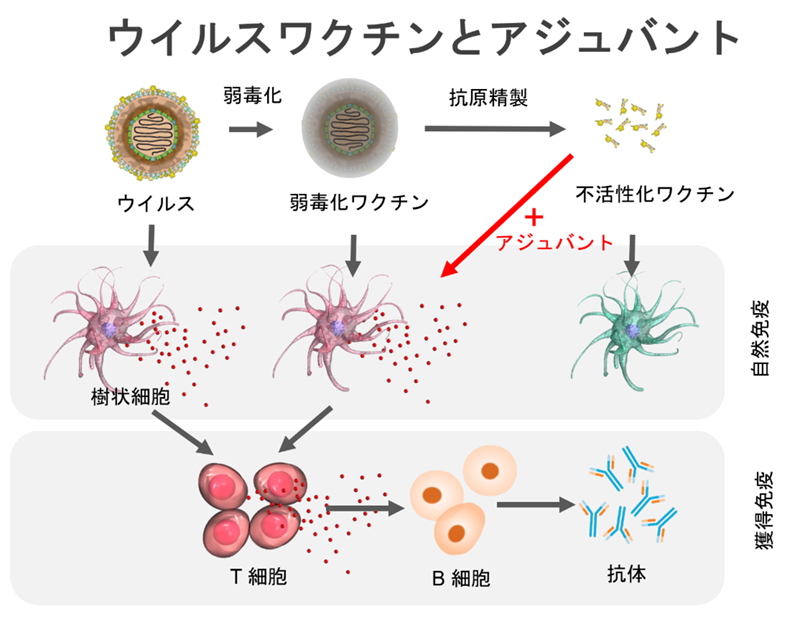
ワクチンは感染症を予防するための最もすぐれた医学的介入です。疾患を引き起こす病原体に由来する弱毒化ワクチン(生ワクチン)は、主に自然免疫と獲得免疫の両方の反応を継続的に刺激するため、効果的なワクチンとして作用します。弱毒化ワクチンは非常に効果的な感染症予防の手段ですが、安全面において改善の余地があります。この課題を解決するために病原体の抗原となる部分を取り出した不活性化ワクチン(サブユニットワクチン、スプリットワクチン)が開発され、臨床的に広く用いられてきました。しかしながら、不活性化ワクチンは十分な免疫原性を有しておらず、十分な免疫応答を誘導するためにはアジュバントと呼ばれる抗原性補強剤との併用が必要です。これまでにアラム(アルミニウム塩)や水中油型エマルションなどが開発されていますが、数が限られています。一般に、免疫応答とアジュバント活性には、分子の大きさが関与していることが知られています。そこで我々は、水中において自発的に集合体を形成する自己集合性小分子化合物に着目し、有機小分子を用いたアジュバントの開発を行いました。
まず、本研究グループが有する小分子化合物ライブラリーから、自己集合性を有する化合物を集めた化合物ライブラリーを構築しました。7万個の化合物のうち8,000個の化合物をスクリーニングし、水中で自己集合する化合物116個を発見しました。これらの化合物は全て、水中において直径が100nmを超える自己集合体の粒子を形成します。
免疫刺激作用を有する自己集合性化合物を発見するために、116個の自己集合性化合物を、マウスの免疫細胞に添加して、免疫活性化の指標となるIL-6の産生量を定量しました。その結果、IL-6産生誘導能を有する化合物1を発見しました。化合物1は、下図左の通り、ジアミンリンカー(青)を介して結合した二つのデオキシコール酸部分(緑)と二つのグリシンエステル(赤)から構成され、対称性の高い構造を有しています。化合物1は約200 nmの球状の粒子を形成し、その形と大きさは典型的なウイルスと似ていました。
より活性の高い化合物を得るため、化合物1の構造最適化を行うこととしました。様々な類縁体化合物を合成し活性を評価したところ、化合物1からグリシンエステル部位(化合物1の赤い部位)を除いて単純化した化合物6(下図右)が強い活性を示しました。この新規化合物を私たちはコリカマイドと名付けました。コリカマイドは水中において約150 nmの球状粒子を形成することを、走査型電子顕微鏡およびクライオ電子顕微鏡により確認しました。
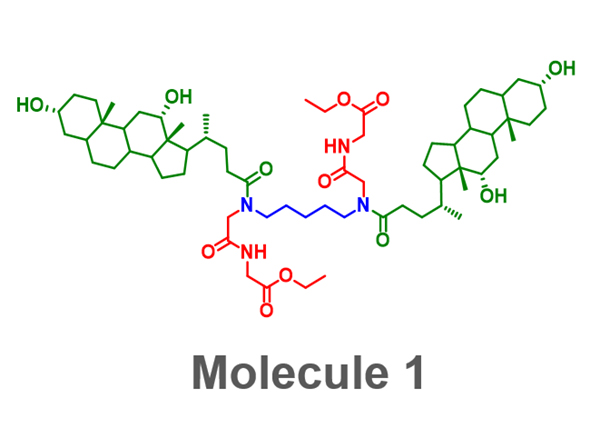
化合物1
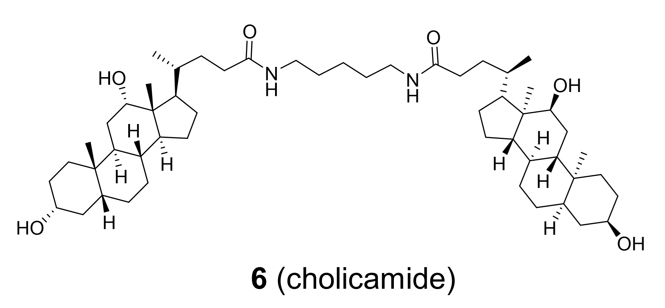
化合物6(コリカマイド)
最後に、化合物1および化合物6(コリカマイド)のアジュバント活性の評価を行いました。化合物1および化合物6と共に、インフルエンザスプリットワクチンをマウスに初日と14日後の二回投与し、初回投与から21日後に血清を採取し、抗ヘマグルチニン特異抗体価を定量しました。その結果、化合物1および化合物6共にコントロール群と比較して、高いIgG産生を誘導することが明らかになりました。特に化合物6は臨床使用されているアジュバントであるアラムに匹敵するIgG産生誘導能を有していることが示されました。その後、各アジュバントによるインフルエンザに対する感染予防効果を検証するため、ワクチン接種後のマウスを致死量のインフルエンザウイルスに感染させ、その後の生存率を3週間に渡って調べました。その結果、構造最適化を行った化合物6と共にワクチン投与されたマウスは、臨床使用されているアジュバントであるアラムと同様に高い生存率を示すことが明らかになりました。ワクチンだけを投与したマウスは12日後までに全てのマウスが死亡しましたが、コリカマイドとともに投与すると21日後でも45%のマウスが生存しました。コリカマイドはマウスにおいてインフルエンザワクチンの作用を増強することが示されました。
コリカマイドは化学構造が単純で工業化が可能であり、今後、コリカマイドやその類縁体は新興ウイルスワクチンのアジュバントとして応用されると期待されます。
●用語解説●
抗ヘマグルチニン特異抗体価:ウイルス感染時にヘマグル二チンは、細胞の表面のレセプターに吸着する役割を持つ。このヘマグル二チンに耐する抗体はウイルスの中和に重要とされ、特異抗体価は、ワクチンの有効性評価のために用いられることがある。
IgG:免疫グロブリンの一種。体内に侵入した病原体やウイルスの抗原と結合して、白血球の働きを助けると共に、ウイルスや細菌が出す毒素と結合して無毒化する。
 京都大学 化学研究所
京都大学 化学研究所 国際共同利用・共同研究拠点
国際共同利用・共同研究拠点