リグニン相互作用解析のための高精度SPRセンサーチップの開発
―バイオマスの化学資源化を目指した精密木質分子変換反応開発への応用に期待―
本成果は、2018年7月9日にアメリカ化学会オープンアクセス誌ACS Omega誌にオンライン公開されました。
京都大学化学研究所の磯﨑勝弘助教、ピンチェラ フランチェスカ博士、上野亮氏(大学院生,当時)、高谷光准教授、中村正治教授らのグループと、下赤卓史助教、長谷川健教授、生存圏研究所の大城理志博士(博士研究員,当時)、山口亜沙子博士(現大阪府立大学)、渡辺隆司教授らの研究グループは、木質バイオマスの主要成分のリグニンを共有結合固定化した高感度SPRセンサーチップの開発に成功し、オリゴペプチドなどを含む様々な分子とリグニンとの相互作用解析に応用可能であることを示しました。
概要
化石資源の枯渇が危ぶまれる現在、再生可能炭素資源である木質バイオマスの有用化合物への有機分子変換手法の開発は人類の持続的な発展を維持するために不可欠な課題です。リグニンとタンパク質(ペプチド)間の相互作用を解明するために、これまでに様々な分析手法が試みられてきました。局在表面プラズモン共鳴(SPR)法は高感度な相互作用解析が可能な手法として注目されていますが、従来法では、リグニンはセンサー表面に物理吸着させるだけで、分析中に脱着してしまうことが問題となっていました。そこで、我々はセンサー表面にアルキン末端を有する自己組織化単分子膜(SAM)を形成し、リグニンに導入したアジド官能基との間でクリック反応を行うことで、リグニンの構造、および表面吸着特性を維持したまま共有結合固定化したSPRセンサーを開発することに成功しました(図1)。
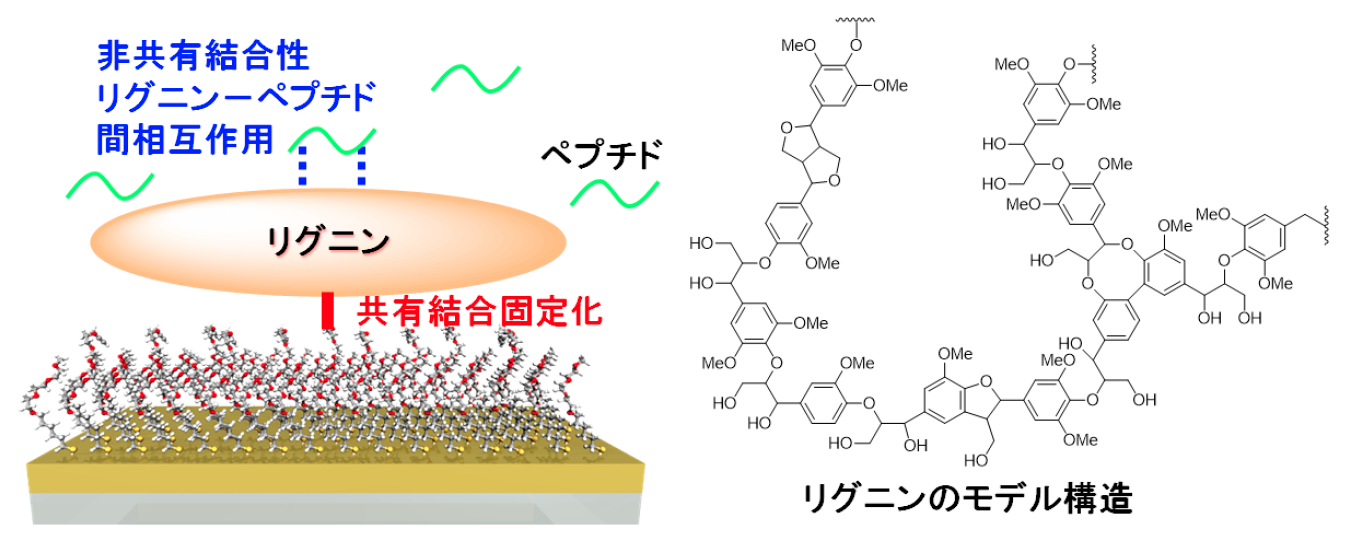

図1.リグニン固定化自己組織化単分子膜(SAM)を有する局在表面プラズモンセンサーチップの模式図(左図)とリグニンのモデル構造(右図)
以前我々が開発した12残基のリグニン認識ペプチドC416を用いて相互作用解析を行った結果、従来法による分析結果と同様の会合定数が再現性良く得られるとともに、従来法で問題となっていた繰り返し利用によるセンサーチップの劣化を克服することに成功しました(図2)。
開発したセンサーチップは通常のSPR測定では吸着分子が脱離するために使用できないジメチルスルホキシド(DMSO)のような有機溶媒を使用しても繰り返し利用可能であることから、従来法では分析できなかった分子間相互作用の大きな生体分子や、リグニンをターゲットとした人工酵素触媒などの相互作用解析にも応用できると考えられます。
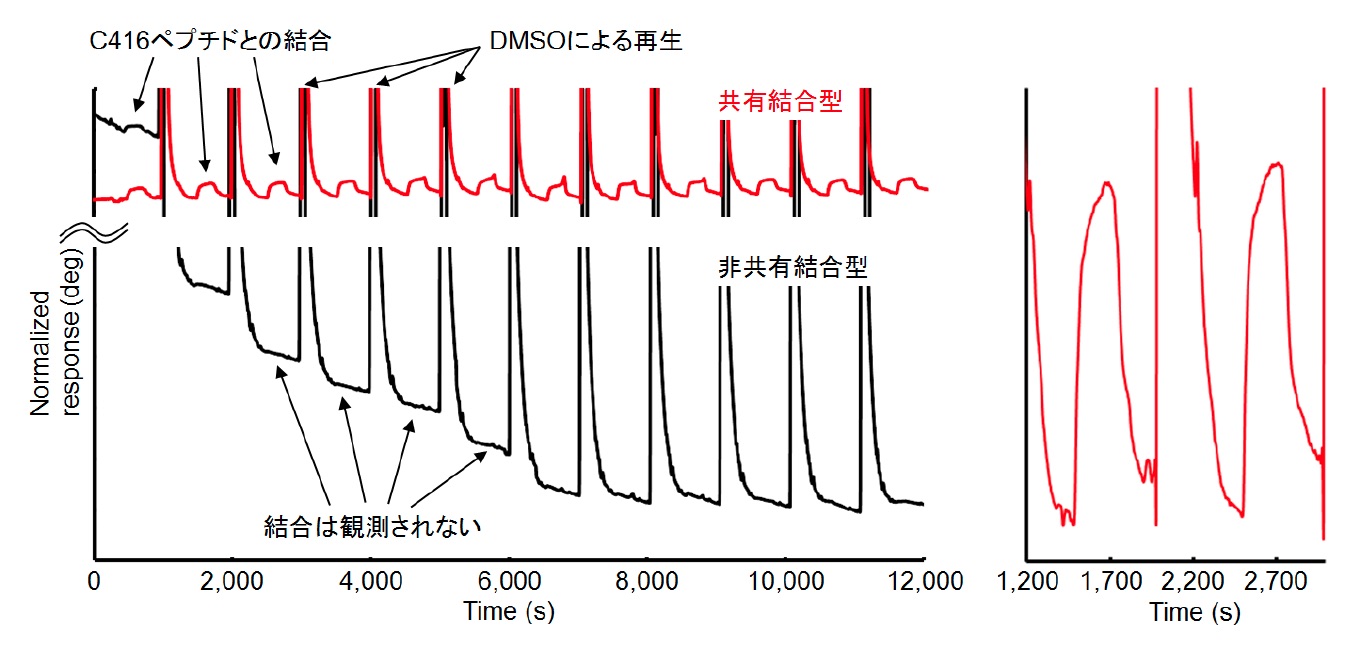
図2.リグニン固定化センサーチップを用いたペプチド相互作用解析の繰り返し測定。赤線:共有結合型、黒線:従来法による非共有結合型チップ(左図)。 拡大図(右図)
●用語解説●
表面プラズモン共鳴(SPR)法: センサーチップの金属表面に分子や物質が吸着する際に生じる極微小な電磁気変化を表面プラズモン共鳴現象を利用してSPR信号として検出し、両者の結合-解離挙動をリアルタイムで定量的に検知する方法。タンパク質(ペプチド)や抗体と標的分子(リガンド)の結合定数の決定によく用いられる。
自己組織化単分子膜(SAM): 分子間にはたらく非共有結合性相互作用を利用して、平坦な金属(もしくは金属酸化物など)表面に分子を自己組織化的に規則正しく配列して結合させた単分子膜。ナノテクノロジー分野をはじめとする各種固体材料の表面修飾に利用される。
本研究は、内閣府 最先端・次世代研究開発支援プログラム、JST CREST、日本学術振興会 科学研究補助金、京都大学化学研究所「化研らしい融合的・開拓的研究助成」、京都大学化学研究所共同利用・共同研究拠点、京都大学生存圏研究所学際萌芽研究、文部科学省特別経費の支援を受けて行われました。
 京都大学 化学研究所
京都大学 化学研究所 国際共同利用・共同研究拠点
国際共同利用・共同研究拠点