平竹 潤助教授ら研究成果「Nature誌」に掲載 ホタルの発光色はなぜ黄緑色なのかを明らかに!
平成18年3月16日、生体触媒化学研究領域 平竹 潤助教授が、理化学研究所 加藤教授らと共同で行った研究成果が英国の科学誌「Nature」に掲載されました。
ルシフェラーゼによる生物発光のスペクトル変化を引き起こす構造的基盤
Structural Basis for Spectral Difference in Luciferase Bioluminescence
本研究内容は、「ホタルの発光色はなぜ黄緑色なのかを酵素の構造から明らかにした」ものです。ホタルの生物発光は、発光基質であるルシ フェリンがルシフェラーゼと呼ばれる酵素によって一連の化学反応を受ける過程で発せられる化学発光がもとになっており、その発光色を決めているのが、酵素 のルシフェラーゼです。すなわち、この酵素の特定の部位に変異が起こると、発光基質が同じでも、オレンジ色や赤色の発光色に変わります。我々は、ゲンジボ タルのルシフェラーゼを使って、黄緑色の発光を示す野生型の酵素と、赤色の発光を示す変異型酵素について、それぞれX線結晶構造解析を行いました。その 際、酵素反応の「反応中間体アナログ阻害剤」をリガンドに使って構造を解いたことが成功の秘訣で、これによって酵素が反応を行っているまさにその瞬間の姿 に近い構造を見ることができました。
その結果、野生型の酵素では、反応中に酵素分子に大きな構造変化が起こり、励起状態の 反応中間体を非常に疎水的な活性中心の中にきわめて強固に結合させることによって無駄なエネルギー損失を抑え、短波長の黄緑色の光を出していることがわか りました。一方、赤色発光を示す変異型酵素では酵素の構造変化が起こらず、励起状態の分子を強く結合することができないため、励起エネルギーが無駄に放出 され、結果的に長波長の赤い光が出ることが判明しました。酵素の大きな構造変化に伴って励起状態が強く結合され、エネルギー損失が抑えられる巧妙な仕組み は、ゲンジボタルに限らず、多くの生物発光に共通して見られる機構ではないかと思われます。
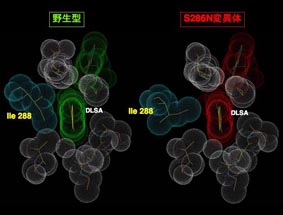
図:反応中間体アナログ阻害剤 DLSA を取り込ませたルシフェラーゼの活性中心の構造(理化学研究所提供)。
黄緑色の発光色を示す野生型の酵素(左)では、反応中間体 (DLSA) がイソロイシン288 の疎水性側鎖によってきわめて強固に固定されているのに対し、赤色発光を示す変異型酵素(右)では、イソロイシン288の側鎖による反応中間体(励起状 態)の固定が甘いことがわかる。
ホタルのルシフェラーゼは、熱を出さずに化学エネルギーを 90% 近い効率で光エネルギーに変換し、世界最高の量子収率を誇る非常に優れた「分子機械」ですが、本研究は、これまで謎だった発光色の変化を分子レベルで明ら かにしたのみならず、化学エネルギーを無駄なく光エネルギーに変換するルシフェラーゼの巧妙な仕組みの一端を、直接目に見える形で明らかにした点にきわめ て大きな科学的意義があります。
Supplementary Information(ムービー2編収録)はこちら
中津 亨1, 2、市山 進1、平竹 潤3、Adrian Saldanha3、小橋伸之1、坂田完三3、加藤博章1, 2(ファーストオーサーは中津助教授、研究リーダーは加藤教授、主たる共同研究者は平竹助教授。以上3名によるほぼ対等の共同研究)
1 理化学研究所・播磨研究所 メンブレンダイナミクス研究グループ 速度論的結晶学研究チーム
2 京都大学大学院薬学研究科、構造生物薬学分野
3 京都大学化学研究所 生体触媒化学研究領域
この研究成果は、以下の各メディアでも紹介されました。
・2006年3月16日
朝日新聞 朝刊、京都新聞 朝刊、日本経済新聞 朝刊
インターネット版(読売新聞、京都新聞、共同通信、時事通信、産經新聞、毎日新聞、朝日新聞)
 京都大学 化学研究所
京都大学 化学研究所 国際共同利用・共同研究拠点
国際共同利用・共同研究拠点